
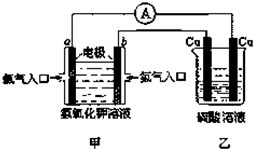
 根据如图所示的装置(甲中电极均为惰性电极)判断下列叙述中正确的是( )
根据如图所示的装置(甲中电极均为惰性电极)判断下列叙述中正确的是( )| A、利用该反应可持续生产硫酸铜,直至硫酸耗尽 |
| B、甲中b电极的电极反应为:4OH--4e-=2H2O+O2↑ |
| C、通电初期乙中的总反应为:通电Cu+H2SO4═CuSO4+H2↑ |
| D、反应过程中甲、乙装置的pH都逐渐减小 |
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、1molCH3+(碳正离子)含有9 NA个电子 |
| B、2.5molHe 中含有10 NA个质子 |
| C、6.02×1022 个H2SO4分子在溶液中可电离出2NA个H+ |
| D、1molFe与盐酸完全反应可失去电子的物质的量为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液中滴加少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | ||||
| B、金属铝与稀硝酸反应:2Al+6H+=2Al3++3H2↑ | ||||
C、向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-
| ||||
| D、碳酸氢铵溶液中加入过量稀盐酸:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚钠溶液中通入少量CO2 2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 | ||
B、乙酸乙酯在酸性条件下水解 CH3COOCH2CH3+H218O
| ||
C、溴乙烷的消去反应 C2H5Br+NaOH
| ||
D、乙醛和银氨溶液反应 CH3CHO+2Ag(NH3)2OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硅酸钠溶液中滴入稀盐酸,溶液变浑浊,说明Cl元素的非金属性强于Si元素 |
| B、Zn与稀硫酸反应时,滴加少量CuSO4溶液,反应速率加快,说明CuSO4在该反应中起催化剂作用 |
| C、用酚酞作指示剂,盐酸滴定Na2CO3溶液,达到滴定终点时,离子浓度关系为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D、将NaAlO2溶液与NaHCO3溶液混合,出现白色沉淀,是两种溶液水解相互促进的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
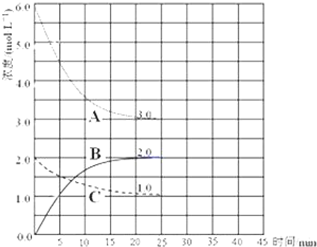 目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;
目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;查看答案和解析>>
科目:高中化学 来源: 题型:
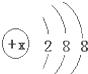 有几种元素的微粒的最外电子层结构如图所示,其中:
有几种元素的微粒的最外电子层结构如图所示,其中:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com