
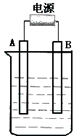
 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:分析 (1)和电源的负极相连的是电解池的阴极,和电源的正极相连的是电解池的阳极;
(2)电解可溶性的铜盐的实质是电解盐和水,根据电极反应书写电解方程式;
(3)根据电解后所得溶液中氢离子的浓度计算溶液的pH,电解后溶液复原,遵循的原则是:出什么加什么,根据元素守恒来计算所加物质的质量.
解答 解:(1)电解液是蓝色溶液,A电极表面有红色的固态物质生成,所以A极是铜离子得电子,所以A极是阴极,A接的是电源的负极,B电极有无色气体生成,则一定是氢氧根失电子产生的氧气,所以B是该装置阳极,和电源的正极相连,故答案为:负;
(2)阴极反应:2Cu2++4e-→2Cu,阳极反应:4OH-→4e-+2H2O+O2↑,电解时反应的总离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,故答案为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;
(3)取出A电极,洗涤、干燥、称量、电极增重1.6g,所以阴极析出金属铜的质量是1.6g,即0.025mol,所以生成氢离子的物质的量为0.05mol,所以c(H+)=$\frac{0.05mol}{0.5L}$=0.1mol/L,即pH=1,电解后析出了金属铜和有氧气放出,所以要想溶液复原,需加入 CuO或CuCO3,所加氧化铜的质量=0.025mol×80g/mol=2g,加碳酸铜时则质量=0.025mol×124g/mol=3.1g,故答案为:1;CuO或CuCO3.
点评 本题考查学生电解池的工作原理,注意电极反应的书写以及电子守恒的计算是关键,难度不大.


科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
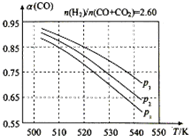 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KOH | B. | Na2CO3 | C. | HClO4 | D. | MgSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com