
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为 ( )
A.6∶1 B.3∶1
C.2∶1 D.1∶2
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:___________________________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_____________________________________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是_________________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是____________
______________________________________________________ ________(写化学式)。
________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
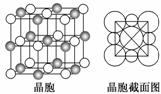
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在同一溶液中一定能大量共存的是( )
A.含大量Ba2+的溶液中:Cl-、K+、S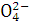 、C
、C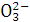
B.含大量H+的溶液中:Mg2+、Na+、C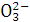 、S
、S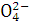
C.含大量OH-的溶液中:K+、N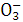 、S
、S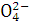 、Cu2+
、Cu2+
D.含大量Na+的溶液中:H+、K+、S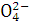 、N
、N
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是 ( )
A.铁粉和氯化铁溶液反应 Fe + 2Fe3+ → 3Fe2+
B.铁和稀盐酸反应 2Fe + 6H+ → 2Fe3+ + H2↑
C.硫化亚铁溶于稀硝酸中:FeS + 2H+ → Fe2++ H2S↑
D.铝和氢氧化钠溶液反应 2Al + 2OH- → 2AlO2- + 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
铝热反应曾用于钢轨焊接,也用于金属冶炼。铝热反应实验时,在固体混合物中间插入一根镁带。
(1)实验时,镁带的作用是 ;
(2)氧化铁和铝粉反应的化学方程式为 ;
(3)当该反应中有0.3 mol电子发生转移时,参加反应的氧化铁的质量为 g。
(4)该反应 (填“吸”或“放”)热,说明反应物总能量 (填“大于”或“小于”)生成物总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 L 0.2mol·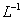 CH3COONa溶液中含有0.2NA个CH3COO—
CH3COONa溶液中含有0.2NA个CH3COO—
B.标准状况下,11.2LCl2溶于水,转移的电子数为NA
C.常温常压下,23g NO2和N2O4的混合气体含有的原子数为1.5NA
D.100 mL 18.4mol·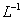 浓硫酸与足量铜加热反应,生成SO2的分子数为0.92NA
浓硫酸与足量铜加热反应,生成SO2的分子数为0.92NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在科研和工农业生产中有广泛应用。
 (1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)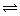 2NH3(g)
2NH3(g)  。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间
。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间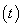 的变化如下图所示:
的变化如下图所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
a.增大压强 b.减小压强 C.升高温度d.降低温度 e.使用催化剂
(2)已知NO2与N2O4可以相互转化: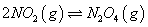 。
。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol·L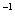 ,则该反应的平衡常数K=_______________;
,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
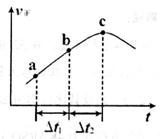 ③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.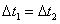 时,NO2的转化率:a~b段小于 b~c段
时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol·L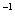 的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3
的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数
H2O的电离平衡常数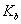 =________________。
=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com