
|
|
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 | | |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | | |
| | |
科目:高中化学 来源:不详 题型:实验题
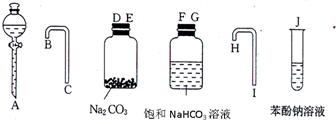
 园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装
园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装 通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: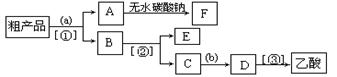
 。
。 分液,分离方法②是蒸馏,分离方法③是分液
分液,分离方法②是蒸馏,分离方法③是分液 ,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下:
,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下: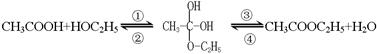
 基。为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是 。
基。为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验组别 | 试管标号 | 所加药品 | 实验现象 (褪色时间) |
| 一 (室温) | 1 | 10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 + 少量硫酸锰固体 | 2s |
| 2 | 10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 | 30s | |
| 二 (室温) | 1 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液+10滴稀硫酸 | 90s |
| 2 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 | 100s | |
| 三 (65℃ 的水浴) | 1 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的 KMnO4溶液 +10滴稀硫酸 | 90s |
| 2 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +1ml稀硫酸 | 100s | |
| 3 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +2ml稀硫酸 | 120s |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 反应结束 |
| 2.0mol/L硫酸 | 无明显现象 | 极少量气泡 | 少量气泡 | ||
| 4.0mol/L硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
| 实验目的 | 实验 编号 | 温度 | 金属铝 形态 | 盐酸浓度 /mol?L-1 |
| 1. 实验①和②探究盐酸浓度对该反应速率的影响; 2. 实验①和③探究温度对该反应速率的影响; 3. 实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响。 | ① | 25?C | 铝片 | 4. 0 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
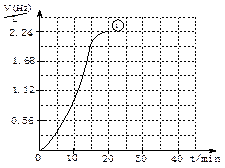 (2)右图为实验①的“H2—t”曲线图,若
(2)右图为实验①的“H2—t”曲线图,若查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中 |
| B.定容摇匀后,发现液面低于刻度线,又加水到刻度 |
| C.定容时俯视刻度线 |
| D.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 相关实验 | 预期目的 |
| A | 把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢。 | 验证接触面积对化学反应速率的影响。 |
| B | 把装有颜色相同的NO2与N2O4混合气体的小试管(密封)分别浸入热水和冷水中,观察试管中气体颜色变化。 | 验证温度对化学平衡的影响。 |
| C | 直接将表面积相同的铝条和镁条投入同温度滴有酚酞的热水中,观察产生气泡的速率及溶液的颜色变化。 | 比较同周期金属元素的金属性强弱。 |
| D | 将足量氯水分别滴入盛有溴化钠溶液和氯化钠溶液的试管中,观察溶液颜色变化。 | 验证溴元素和碘元素的非金属性强弱。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com