
【题目】某冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如下:
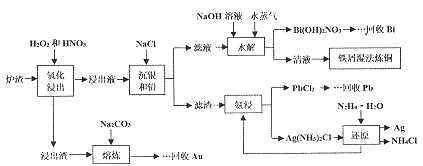
回答下列问题:
(1)加快“氧化浸出”速率的措施有________________。 (写出两种)。
(2)加入NaOH溶液的目的是调节滤液的pH,水解时通入水蒸气的目的是________。
(3)温法炼铜后溶液中主要的物质有(写化学式)____________。
(4)氨浸实验时,需要在常温下进行的原因是_________;熔炼时加入Na2CO3的目的是除硅,写出反应方程式____________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+):c(Ag+)=103时,溶液中的c(C1-)=______mol/L。
(6)写出流程中还原制银的化学方程式____________________。
【答案】 搅拌、废渣粉碎或其它合理答案 加快水解速率,促进Bi3+的水解 Fe(NO3)2、NaNO3 温度高,氨气易挥发 SiO2+Na2CO3![]() Na2SiO3+CO2↑ 100 4Ag(NH3)2Cl+N2H4·H2O=4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O或4Ag(NH3)2Cl+N2H4=4Ag↓+N2↑+4NH3↑+4NH4Cl或4Ag(NH3)2Cl+N2H4·H2O+3H2O=4Ag↓+N2↑+4NH3·H2O+4NH4Cl
Na2SiO3+CO2↑ 100 4Ag(NH3)2Cl+N2H4·H2O=4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O或4Ag(NH3)2Cl+N2H4=4Ag↓+N2↑+4NH3↑+4NH4Cl或4Ag(NH3)2Cl+N2H4·H2O+3H2O=4Ag↓+N2↑+4NH3·H2O+4NH4Cl
【解析】(1)加快固体炉渣溶解、提高反应速率的常用的措施有搅拌、粉碎、适当加热等;
(2)水解时通入水蒸气能适当提高温度,促进Bi3+的水解,有利于分离Cu2+ 和Bi3+;
(3)用铁屑温法炼铜的化学方程式为Cu(NO3)2+Fe=Fe(NO3)2+Cu,因此溶液中的主要物质有Fe(NO3)2、NaNO3;
(4)防止温度过高,氨水大量挥发或分解;在高温下熔炼时,加入的Na2CO3可与SiO2反应,化学方程式为SiO2+Na2CO3 ![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
(5)设溶液中的c (C1-)为x,则AgCl沉淀时需要的c(Ag+)= ![]() ,PbCl2沉淀时需要的c(Pb2+ ) =
,PbCl2沉淀时需要的c(Pb2+ ) = ![]() ,当c(Pb2+):c(Ag+)=103时,求得x= 100 mol/L
,当c(Pb2+):c(Ag+)=103时,求得x= 100 mol/L
(6)流程中还原制银时,Ag+化合价降低生成Ag,则只有N2H4·H2O中-2价的N元素化合价升高生成N2,结合生成物NH4Cl,根据电子转移守恒和质量守恒可写出反应的化学方程式为4Ag(NH3)2Cl+N2H4·H2O=4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示(上端为多孔电极a,下断为多孔电极b),该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法不正确的是

A.工作时电极b作正极,O2-由电极b流向电极a
B.工作时电子由电极a通过介质流向电极b
C.负极的电极反应式为:CO+O2—―2e-=CO2
D.传感器中通过的电流越大,尾气中CO的含量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的序号填写在空格上:①淀粉和纤维素;②D2O与T2O; ③12C和14C;④金刚石与石墨;⑤![]() ;⑥CH4和异丁烷;⑦葡萄糖和果糖;⑧淀粉和果糖
;⑥CH4和异丁烷;⑦葡萄糖和果糖;⑧淀粉和果糖
(1)互为同位素的是________;
(2)互为同分异构体的是________;
(3)互为同素异形体是________;
(4)互为同系物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol氦气所含原子的数目为2NA
B.12 g 12C中所含的碳原子数为NA
C.标况下22.4 L的任何气体所含原子数均为NA
D.相同体积的O2(g)和NO2(g)分子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为_________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O)2] 3+的几何异构体种数有(不考虑光学异构)___________种。
(3)金属钴是由______键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,Co2+和Fe2+的离子半径分别为74.5pm和78pm,则熔点CoO______FeO。
(4)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿佛加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下图所示装置:
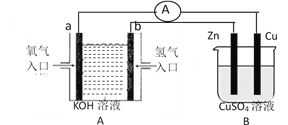
(1)装置A中b的电极名称为________极,a电极反应式为___________________________________;
(2)B装置中Cu为________极,电极反应式为___________________________________;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为______________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10L0.1mol·L-1氨水与10L0.1mol·L-1盐酸混合:[Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1mol·L-1NH4Cl溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
D. 10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是人体重要的营养物质,是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G的蒸气密度是E蒸气密度的2倍。它们之间的转化关系如图:

(1)向试管中加入2mL10%氢氧化钠溶液,滴加4-5滴5%硫酸铜溶液,振荡后加入2mL10%的E的溶液,加热,可观察到的现象是___________。
(2)写出C和F在浓H2SO4作用下生成G的化学方程式________,该反应的类型是______。
(3)已知D和F在催化剂作用下反应也能生成G,写出该反应的化学方程式______。
(4)下列说法不正确的是________。
a.要确定A已发生部分水解,先将水解液中和成碱性,再用银氨溶液和碘水分别检验
b.有机物B、C、D和G均能使酸性KMnO4溶液褪色
c.将足量的D通入溴水中,可以观察到溴水褪色,溶液分层
d.某烃X的相对分子质量是D、H之和,则X能与溴水发生加成反应
(5)写出比G少一个碳原子的同系物的可能结构简式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com