
| A. | Fe2+ | B. | Fe3+ | C. | Fe3O4 | D. | FeO |
分析 根据元素化合价的高低判断微粒的氧化性、还原性,最高价态的只有氧化性,最低价态的只有还原性,中间价态的既有氧化性又有还原性,据此进行解答.
解答 解:A.Fe2+的化合价处于中间价态,所以既有氧化性又有还原性,故A错误;
B.Fe3+的化合价处于最高价态,所以只有氧化性,故B正确;
C.Fe3O4中铁的化合价既有+3价,又有+2价,所以Fe3O4既有氧化性又有还原性,故C错误;
D.FeO中铁元素的化合价为+2价,则氧化亚铁既有氧化性又有还原性,故D错误;
故选B.
点评 本题考查了氧化还原反应,题目难度不大,注意掌握氧化性、还原性的概念及判断方法,明确判断微粒氧化性还原性的规律:最高价态的只有氧化性,最低价态的只有还原性,中间价态的既有氧化性又有还原性.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
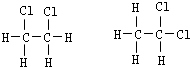 E、
E、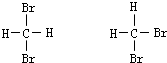
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③④ | C. | ②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次增强 | B. | HF、HCl、H2S的稳定性依次增强 | ||
| C. | H、Li、Na的原子半径依次增大 | D. | KOH、Mg(OH)2、Al(OH)3的碱依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 定容时,如果加水超过了刻度线,可用蒸发皿蒸出少量水后重新定容 | |
| C. | 配制稀硫酸时,先在烧杯中加入一定量水,再沿玻璃棒慢慢加入浓硫酸 | |
| D. | 称量NaOH时,NaOH置于小烧杯中放在托盘天平左盘,砝码放在右盘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com