
【题目】在容积为0.4L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
(1)该反应的△H_______0(填“>”或“<”下同)。
(2)100℃时,体系中各物质浓度随时间变化如图所示。
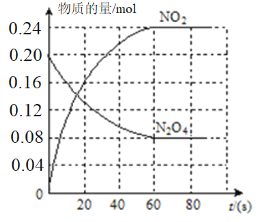
在0~60s时段,反应速率v(N2O4)为__________;反应的平衡常数K的值为_________。反应达平衡后,再向容器中充入0.4molN2O4。平衡向_________(填“正反应”或“逆反应”)方向移动,再次达到平衡时,N2O4的转化率与原平衡相比_________(填“变大”“变小”或“不变”)。
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则反应达平衡之前v正_____v逆。
【答案】 > 0.3mol/(L·min)或0.005mol/(L·s) 1.8mol/L 正反应 变小 <
【解析】(1)根据温度对平衡状态的影响分析;
(2)根据反应速率v=△c/△t计算;利用化学平衡常数表达式计算化学平衡常数;根据外界条件对平衡状态的影响结合反应方程式判断;
(3)根据浓度熵与平衡常数的关系判断。
(1)若升高温度,混合气体的颜色变深,NO2浓度增大,N2O4的浓度降低,平衡向正反应方向移动,因此正反应方向吸热,则△H>0;
(2)0~60s时段内,N2O4浓度变化为:0.50mol/L-0.20mol/L=0.30mol/L,则v(N2O4)=0.30mol/L÷60s=0.005mol/(L·s);根据图像可知平衡时NO2浓度是0.6mol/L,N2O4浓度是0.2mol/L,所以反应的平衡常数K=![]() ;由于反应物和生成物均只有一种,因此反应达平衡后,再向容器中充入0.4molN2O4,相当于是增大压强,平衡向逆反应方向移动,所以再次达到平衡时,N2O4的转化率与原平衡相比变小。
;由于反应物和生成物均只有一种,因此反应达平衡后,再向容器中充入0.4molN2O4,相当于是增大压强,平衡向逆反应方向移动,所以再次达到平衡时,N2O4的转化率与原平衡相比变小。
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则此时浓度熵是![]() >1.8,因此反应向逆反应方向进行,则反应达平衡之前v正<v逆。
>1.8,因此反应向逆反应方向进行,则反应达平衡之前v正<v逆。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物是大气的主要污染物之一,能形成酸雨、雾霾。大气中的氮氧化物主要来源于燃料的燃烧。
(1)已知:N2(g)+O2(g)![]() 2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
2NO(g)ΔH=-180.5kJ·mol-1。N≡N键能941kJ·mol-1、O=O键能499kJ·mol-1,则NO中N≡O键的键能为___________ kJ·mol-1。
(2)T℃时,向1L恒容密闭容器中充入1molN2O3和1molO2,发生反应;N2O3(g)+O2(g)![]() N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
N2O5(g) ΔH=-62kJ·mol-1。若平衡时N2O3和N2O5的体积分数相等,则T℃时,该反应的平衡常数K=_____________。
(3)用活化后的N2O5作催化剂,氨气可将NO和O2还原成N2和H2O。若参加反应的NH3和NO的物质的量相等,则该反应的化学方程式为___________。已知该反应的平衡常数与温度的关系为lg K=5.08+![]() 。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
。若该反应在t℃下达到平衡,升高温度时,平衡___________(填“正向“逆向“或“不”)移动,逆反应速率将____________(填“增大”“减小”或“不变”)。
(4)图I是用食盐水作电解液电解烟气脱氮的一种原理图,NO 被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后再排入空气中。电流密度和溶液pH对烟气脱氮的影响如图II。
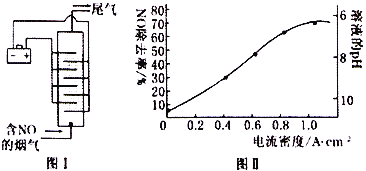
①处理后的尾气中,一定含有的气体单质是___________(填化学式)。
②溶液的pH对NO除去率有影响的原因是___________。
③若电极板面积为10cm2,实验烟气含NO的体积分数为1.5%,流速为0.070 L·s-1(气体体积已折算成标准状况,且烟气中无其他气体被氧化),测得电流密度为1.0A·cm-2。实验中NO除去率为___________(法拉第常数为96500C·mol-1))。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】勒夏特列原理往往适用于化学学科中的各种平衡理论,请回答下列问题:
(1)氯水可以杀菌消毒。氯水中存在多个平衡,含氯元素的化学平衡有__________个。氯水处理饮用水时,在夏季的杀菌效果比在冬季差,可能的原因是__________(一种原因即可)。在氯水中,下列关系正确的是_________(选填编号)。
a.c(H+)=c(ClO-)+c(Cl-) b.c(Cl-)=c(ClO-)+c(HClO) c.c(HClO)<c(Cl-) d.c(Cl-)<c(ClO-)
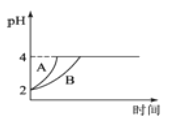
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则图中表示盐酸溶液中pH变化曲线的是__________(填“A”或“B”),反应开始时,产生H2的速率A__________B;加入足量Zn粒使酸均完全反应,产生H2的体积(相同状况下)A__________B(填“>”、“<”或“=”)
(3)难溶电解质在水溶液中存在溶解平衡,某MSO4溶液里c(M2+)=0.002mol·L-1,如果要将M2+完全转化成M(OH)2沉淀,应调整溶液pH的范围是______________[该温度下M(OH)2的Ksp=1×10-12,一般认为离子浓度≤1×10-5mol/L为完全沉淀]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组欲制取SO2,并探究SO2与FeCl3溶液的反应。在图中选用必要装置完成实验。

(1)所选装置按气流方向的连接顺序为_________(填仪器接口的字母编号)。
(2)装置A中盛放浓硫酸和铜片的仪器名称为________,发生反应的化学方程式为______。
(3)欲配制装置C中100mL1mol/LFeCl3溶液,需要用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_______;所配溶液需用盐酸酸化,请结合离子方程式解释原因: _______ 。
(4)实验过程中观察到装置C中的实验现象为溶液由棕黄色变成红棕色,最终变成浅绿色。甲同学认为红棕色的出现,可能是产生了Fe(OH)3胶体,再混合其他颜色导致;乙同学查阅资料发现Fe(HSO3)2+为红棕色,且具有较强的还原性,认为红棕色是Fe(HSO3)2+所引起。你认为____(填“甲”或“乙”)同学分析较为合理,原因为__________,验证两位同学结论的方法为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲和乙均是盐桥原电池装置。请按要求填空
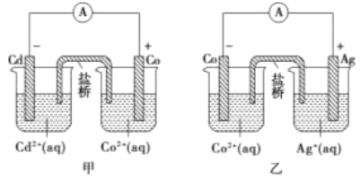
(1)甲中Co电极发生的反应方程式为_____________________________________。
(2)两烧杯中盐桥(填充物为浸有饱和KNO3溶液的琼脂)的作用是__________并使两烧杯中溶液保持电中性。
(3)判断反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能否自发进行并解释理由_________________________。
(4)开始时,乙电池左右烧杯各含100溶液,且Co2+、Ag+浓度均为4mol/L,当有1.204×1022个电子通过外电路时,两烧杯溶液中Co2+、Ag+浓度差为__________(忽略溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中,中心原子的杂化轨道类型相同,空间构型也相同的是( )
A.BeCl2 CO2
B.H2O SO2
C.BF3 NCl3
D.SiCl4 SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为: C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
根据以上数据,写出C(s)与水蒸气反应生成CO(g)和H2(g)的热化学方程式: .
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键键能: P﹣P 198kJmol﹣1 , Cl﹣Cl 243kJmol﹣1 , P﹣Cl 331kJmol﹣1 .
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热△H= . 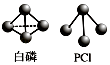
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:

已知:![]()
请回答下列问题:
(1)A的化学名称为___________,F的结构简式为______________。
(2)B中官能团的名称为______________。
(3)F→G的反应类型为__________________。
(4)D+G→M的化学方程式为_________________。
(5)写出同时满足下列条件的D的同分异构体的结构简式___________。
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线______________________。
的合成路线______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com