
氧化还原反应中实验上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3―+4H++3e―→NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原反应过程发生。
(1)写出并配平该氧化还原反应的离子方程式:
(2)反应中硝酸体现了 和 性质。
(3)反应中若产生0.5mol气体,则转移电子的物质的量是 mol
(4)若1mol甲与某浓度硝酸反应时,和(1)反应相比被还原硝酸的物质的量增加,原因是: 。
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:阅读理解
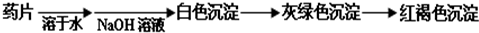
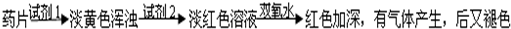
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断不正确的是
A.上述实验证明氧化性:![]() >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B.上述实验中的三个主要反应都是氧化还原反应
C.实验②证明Fe2+既有氧化性又有还原性
D.实验①产生的气体同样能使湿润的淀粉KI试纸变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体:
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断正确的是( )
A.上述实验证明氧化性:MnO-4>Cl2>Fe2+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com