
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:| 时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
| CO | 0.200 | 0.138 | C1 | C1 | 0.116 | 0.096 |
| H2O | 0.300 | 0.238 | C2 | C2 | 0.216 | 0.266 |
| CO2 | 0 | 0.062 | C3 | C3 | 0.084 | |
| H2 | 0 | 0.062 | C3 | C3 | 0.104 |
分析 (1)0~4min内△c(CO)=(0.2-0.08)mol/L=0.12mol/L,根据v=$\frac{△c}{△t}$计算v(CO);
(2)①由表中数据可知,3min、4min时相同组分的浓度相同,故处于平衡状态;
该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,氢气浓度变化大于二氧化碳浓度变化,故可能增大氢气的浓度;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L,故应该是增大水蒸气的浓度.
解答 解:(1)0~4min内△c(CO)=(0.2-0.08)mol/L=0.12mol/L,故v(CO)=$\frac{0.12mol/L}{4min}$=0.03mol/(L.min),故答案为:0.03;
(2)①由表中数据可知,3min、4min时相同组分的浓度相同,故处于平衡状态;
该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大,
故答案为:平衡,大于;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,氢气浓度变化大于二氧化碳浓度变化,故可能增大氢气的浓度;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L,故应该是增大水蒸气的浓度,
故答案为:D;A.
点评 本题考查化学平衡的有关计算及影响因素、反应速率的计算、化学平衡图象等,难度中等,(2)中注意分析各物质的浓度变化量关系判断改变条件.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4N}{V}$ mol-1 | B. | $\frac{VN}{22.4}$mol-1 | C. | $\frac{VN}{11.2}$ mol-1 | D. | $\frac{11.2N}{V}$ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X分子中最多可有9个碳原子共平面 | |
| B. | X可以发生取代、加成、聚合等反应 | |
| C. | 1 mol X与足量NaHCO3溶液反应所得物质的分子式为C9H7O4Na | |
| D. | 苯环上的取代基与X完全相同的X的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe的质量为2.7g,Al的质量为2.8g | B. | Fe的质量为2.8g,Al的质量为2.7g | ||
| C. | Fe的质量为5.4g,Al的质量为5.6g | D. | Fe的质量为5.6g,Al的质量为5.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
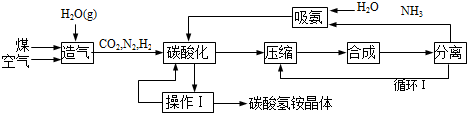

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
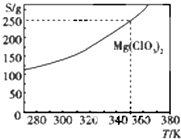 Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ | |
| D. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液不分层,呈现黄色 | B. | 溶液分层,上层为水层,无色 | ||
| C. | 溶液分层,上层为苯层,紫色 | D. | 溶液分层,下层为苯层,紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com