
| A、厨房中用的食盐、食醋都是电解质 |
| B、大量燃烧化石燃料是造成雾霾天气的重要原因 |
| C、盐类都可做调味品 |
| D、浓硫酸可以用来雕刻玻璃制工艺品 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、宇宙飞船中使用的碳纤维,是一种新型无机非金属材料 |
| B、氢氧化铁溶胶、含塑化剂的白酒、含有细菌的矿泉水均具有丁达尔效应 |
| C、“地沟油”经过加工处理后,可以用于制肥皂和生物柴油 |
| D、化石燃料的大量使用是产生PM2.5的主要原因之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、56g铁片投入足量冷的浓硝酸中,转移3NA个电子 |
| B、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| C、1molNa2O2固体中含离子总数为4NA |
| D、常温常压下,22.4L氟化氢中含有氟原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B、向煮沸的1 mol?L-1NaOH溶液中滴加FeCl3饱和溶液可制备Fe(OH)3胶体 |
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和含等物质的量HCl的盐酸 |
| D、锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用酸去除 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)=C(金刚石)△H=+1.90kJ?mol-1 可知,金刚石比石墨稳定 |
| C、一定条件下,将0 5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H═-38.6kJ?mol-1 |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(Ⅰ)△H=-57.3kJ?mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4LNO2含有2NA 个氧原子 |
| B、0.1mol?L-1的NaNO3溶液中含有0.1NA 个NO3- |
| C、常温下,34gNH3含有6NA 个N-H共价键 |
| D、1mol Fe2+与足量的Cl2反应,转移2NA 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
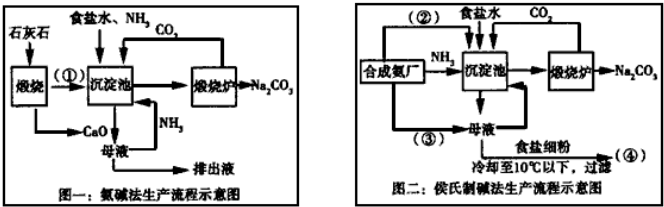
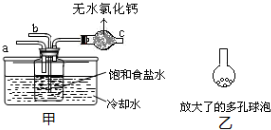
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com