
| 1mol |
| 1 |


科目:高中化学 来源: 题型:
| A、Na+、S2-、K+、NO3- |
| B、NH4+、NO3-、Al3+、K+ |
| C、MnO4-、K+、CO32-、Na+ |
| D、K+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
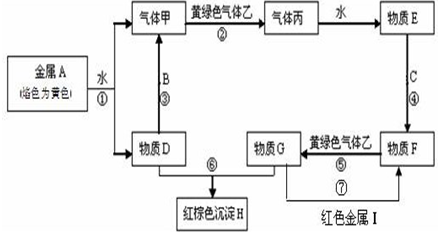 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 |
0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| C、c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、c(CO32-)>c(OH-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 LH2O含有的水分子数为NA |
| B、22gCO2含有的CO2分子数为0.5NA |
| C、44gCO2气体含有的氧原子数为2NA |
| D、40g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com