
| A. | 是金属元素 | B. | 是IIA族元素 | C. | 是非金属元素 | D. | 无法确定 |
科目:高中化学 来源: 题型:填空题
 中的两种基团组成的化合物,与NaOH溶液恰好完全发生反应,反应后所得产物中再通入二氧化碳,也能发生反应的物质可能是苯酚钠、碳酸钠.
中的两种基团组成的化合物,与NaOH溶液恰好完全发生反应,反应后所得产物中再通入二氧化碳,也能发生反应的物质可能是苯酚钠、碳酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3+Ca2++OH-=CaCO3↓+H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO+H20+CO2=CaCO3↓+2HClO | |
| C. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:Ba2++2OH+2H++SO42-=BaSO4↓+2H2O | |
| D. | 碳酸氢钙溶液中加入盐酸:HCO3+H+=CO2↑+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞试液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③用小刀切割一小块钠擦干煤油后放入滴有酚酞试液的装有冷水的烧杯中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将打磨后的镁投入装有稀盐酸的试管中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将打磨后的铝投入装有稀盐酸的试管中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.
已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.
 同分异构体的结构简式:
同分异构体的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
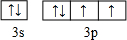 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空
(1)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com