
| A. | 相对分子质量相同,组成元素也相同的化合物一定是同分异构体 | |
| B. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定是同分异构体 | |
| D. | 分子式相同的不同有机物一定互为同分异构体 |
分析 同系物指结构相似,在分子组成上相差一个或若干个CH2原子团的物质,具有如下特征:结构相似、化学性质相似、分子式通式相同,分子式不同、物理性质不同,研究范围为有机物;
同分异构体指分子式相同,结构不同的化合物,具有如下特征:分子式相同,结构不同、物理性质不同、不同类时化学性质不同,研究范围多为有机物.
解答 解:A、同分异构体的相对分子质量相同,组成元素也相同,但相对分子质量相同,组成元素也相同的化合物分子式不一定相同,所以不一定是同分异构体,如甲酸与乙醇,故A错误;
B、分子结构不相似,即使分子组成相差一个或若干个CH2原子团的物质,也不是同系物,如甲酸甲酯与丙酸,故B错误;
C、同分异构体的组成元素相同,各元素质量分数也相同,但组成元素相同,各元素质量分数也相同的物质分子式不一定相同,所以不一定是同分异构体,如乙炔与苯,故C错误;
D、分子式相同,各组成元素的质量分数一定相同,不同有机物,说明结构不同,一定互为同分异构体,故D正确.
故选D.
点评 本题以有机物的结构为载体考查同系物、同分异构体,难度不大,注意有机化学“五同”理解辨析.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
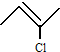 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
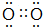 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生电化学腐蚀时,负极反应为Fe-3e-=Fe3+ | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁制品中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
 .
. ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
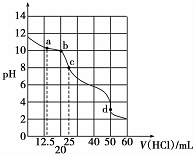 在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO3-)>c(OH-) | B. | b点:5c(Cl-)>4c( HCO3-)+4c(CO32-) | ||
| C. | c点:c( OH -)=c(H+)+c(HCO3-)+2c(H2CO3) | D. | d点:c(H+)=c(CO32-)+c( HCO3-)+c(OH -) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com