解:Ⅰ由于亚硫酸钠被氧化的程度只能存在三种情况:没有被氧化、部分被氧化、完全被氧化,所以方案三为:亚硫酸钠部分被氧化;要证明亚硫酸钠部分被氧化,需要证明需要证明亚硫酸钠中存在硫酸根离子和亚硫酸根离子,方法为:取少量亚硫酸钠样品滴加过量BaCl
2,再滴加稀盐酸,若能产生白色沉淀,滴加盐酸后白色沉淀部分溶解,则可证明(或取少量亚硫酸钠样品,滴加过量稀盐酸后,再滴加BaCl
2溶液,若开始有无色刺激性气体产生,后滴加有白色沉淀,则可证明),
故答案为:亚硫酸钠部分被氧化;取少量亚硫酸钠样品滴加过量BaCl
2,再滴加稀盐酸,若能产生白色沉淀,滴加盐酸后白色沉淀部分溶解,则可证明(或取少量亚硫酸钠样品,滴加过量稀盐酸后,再滴加BaCl
2溶液,若开始有无色刺激性气体产生,后滴加有白色沉淀,则可证明);
Ⅱ:(1)二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl
2+SO
2+2H
2O═4H
++2Cl
-+SO
42-,
故答案为:Cl
2+SO
2+2H
2O=4H
++2Cl
-+SO
42-;
(2)根据硫元素守恒计算,
Na
2SO
3~SO
2~BaSO
4126g 233g
m bg
解得:m=
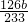
,原样品中Na
2SO
3的质量分数为:

×100%,
由于装置中有残留的二氧化硫没有与氯气反应,对测定结果会造成影响,
故答案为:

×100%;残留在装置中的SO
2没有被氧化.
分析:Ⅰ亚硫酸钠被氧化的程度存在三种情况:没有被氧化、部分被氧化、完全被氧化;证明亚硫酸钠部分被氧化,需要证明亚硫酸钠中存在硫酸根离子和亚硫酸根离子;
Ⅱ(1)二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸;
(2)根据硫元素守恒计算,Na
2SO
3~SO
2~BaSO
4;反应装置中有残留的二氧化硫没有被氧化,会影响测定结果.
点评:本实验比较常规,应该说是考查基础知识的掌握程度,涉及了考查装置气密性检查的方法、考查尾气处理、方程式书写、考查实验设计能力.

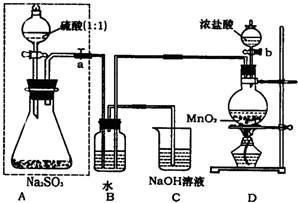 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案: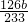 ,原样品中Na2SO3的质量分数为:
,原样品中Na2SO3的质量分数为: ×100%,
×100%, ×100%;残留在装置中的SO2没有被氧化.
×100%;残留在装置中的SO2没有被氧化.

 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案: