
 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去): .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.分析 (1)羰基硫分子与二氧化碳分子结构相似,均为直线型;反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3;
(2)硫化钠与水反应生成S2O32-、氢气和氢氧化钠,根据电子守恒和原子守恒书写;
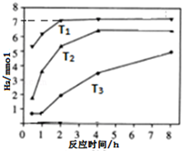
(3)a.由图可知,温度高的反应速率大,则反应的时间短;
b.3molNa2S若只生成S2O32-转移12mol电子,T1温度下,生成的氢气为7mol,转移电子为14mol,结合电子守恒计算.
解答 解:(1)羰基硫分子与二氧化碳分子结构相似,均为直线型,其电子式为 ,反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,故答案为:
,反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,故答案为: ;COS+4NaOH=Na2S+Na2CO3+2H2O;
;COS+4NaOH=Na2S+Na2CO3+2H2O;
(2)硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+5H2O=S2O32-+4H2↑+2OH-,故答案为:2S2-+5H2O=S2O32-+4H2↑+2OH-;
(3)a.由图可知,温度高的反应速率大,则反应的时间短,则T1>T2>T3,故答案为:T1>T2>T3;
b.3molNa2S若只生成S2O32-转移12mol电子,T1温度下,生成的氢气为7mol,转移电子为14mol,设产生的SO42-为x,由电子守恒可知x×8+(3-x)×4=14,解得x=0.5mol,则n(S2O32-)=$\frac{3-0.5}{2}$=1.25mol,溶液中c(S2O32-):c(SO42-)=1.25:0.5=5:2,
故答案为:5:2.
点评 本题考查较综合,涉及电子式、氧化还原反应计算、离子反应等,侧重反应原理中高频考点的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示,下列关于该化合物的说法不正确的是( )
维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示,下列关于该化合物的说法不正确的是( )| A. | 维生素A能使溴水褪色 | |
| B. | 维生素A能与金属钠发生反应并放出氢气 | |
| C. | 维生素A的一个分子中有3个双键 | |
| D. | 维生素A能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯从溴水中萃取溴、氯化钠潮解 | B. | 海水蒸馏制淡水、石油裂化 | ||
| C. | 碘的升华、煤的气化 | D. | 石油分馏得到汽油、SO2漂白草帽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 试剂 | 试管中的物质 |  | |
| A | 苯环对甲基的影响 | 酸性KMnO4溶液 | ①苯②甲苯 | |
| B | 比较Br-、Fe2+和I-的还原性 | 氯水 | ①FeBr2溶液 ②FeI2溶液 | |
| C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 | |
| D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液②碳酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、CO32-、SO42- | B. | K+、Ag+、H+、Cl- | ||
| C. | Al3+、H+、NO3-、SO42- | D. | Fe3+、K+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO2 | |
| B. | 标准状况下44.8LH2 | |
| C. | 32gO2 | |
| D. | 1L 1mol/L的碳酸钠溶液中含有的溶质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com