
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g) 2SO3(g) ∆H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ∆H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 | [ |
下列说法不正确的是( )
A.反应在前5min的平均速率为v (SO2)=0.08mol·L?1 min?1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入2.5mol SO3,达平衡时SO3的转化率小于40%
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年河南省高二下期末模拟化学试卷(解析版) 题型:选择题
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐。下列说法正确的是:
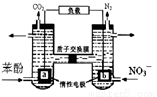
A.a为正极
B.若右池产生0.672L气体(标况下),则转移电子0.15mol
C.左池电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+
D.左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西西北大学附中高二下期末化学试卷(解析版) 题型:填空题
填写下列空白 [第(1)~(4)小题用元素符号填写]。
(1)第三周期原子半径最小的元素__________。
(2)第一电离能最大的元素__________。
(3)电负性最大的元素__________。
(4)第四周期中第一电离能最小的元素__________。
(5)含有8个质子,10个中子的原子的化学符号__________。
(6)最外层电子排布为4s24p1的原子的核电荷数为__________。
(7)周期表中最活泼的非金属元素原子的电子排布图为______________________________。
(8)某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素的离子结构示意图__________。
(9)写出基态铜原子的电子排布式________________,位于__________区。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西西北大学附中高二下期末化学试卷(解析版) 题型:选择题
下列物质的性质与氢键无关的是 ( )
A.冰的密度比水的密度小
B.氨气极易溶于水
C.SbH3的沸点比PH3的高
D.溶解度:邻羟基苯甲醛<对羟基苯甲醛
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二下期末化学试卷(解析版) 题型:实验题
草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2,K2=5.4×10﹣5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解为CO、CO2和H2O。回答下列问题:
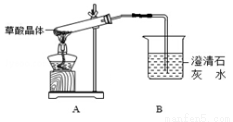
(1)写出草酸晶体分解的化学方程式_________________________________。
(2)甲组同学按照如图所 示的装置,通过实验检验草酸晶体的分解产物。若实验过程中,B中澄清石灰水变浑浊,______(填“能”或“不能”)说明草酸晶体的分解产物中有CO2,原因是______。
示的装置,通过实验检验草酸晶体的分解产物。若实验过程中,B中澄清石灰水变浑浊,______(填“能”或“不能”)说明草酸晶体的分解产物中有CO2,原因是______。
(3)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A和如图所示的部分装置(可以重复选用)进行实验。
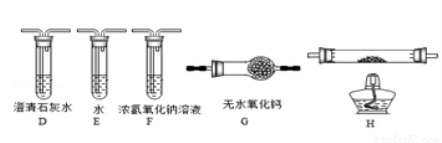
①乙组同学的实验装置中,依次连接的合理顺序为A →___→____→G→ →____。装置H反应管中盛有的物质是  。
。
②F装置的作用是________ ___________________________。
___________________________。
③能证明草酸晶体分解产物中有CO的现象是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二下期末化学试卷(解析版) 题型:选择题
海水开发利用的部分过程如图所示。下列说法错误的是( )
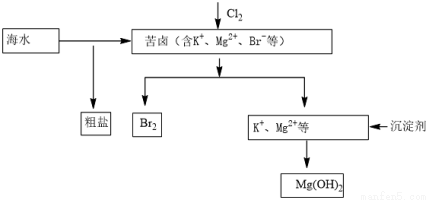
A.工业生产中常选用NaOH作为沉淀剂
B.粗盐可采用溶解、过滤和重结晶等过程进一步提纯
C.向苦卤中通入Cl2是为了提取溴
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二下期末化学试卷(解析版) 题型:选择题
常温下,下列溶液中各组离子一定大量共存的是( )
A.使pH试纸呈红色的溶液中:Na+、AlO2—、NO3—、CO32—
B.遇苯酚溶液显紫色的溶液:Na+、SO32-、S2-、Cl-
C.含有0.1 mol·L-1 HCO的溶液:Na+、K+、NO、C6H5O-
D.水电离出的H+浓度为1.0×10-12 mol·L-1的溶液:Na+、Fe3+、SO42-、NO3—
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期末化学试卷(解析版) 题型:实验题
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取无水氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体。
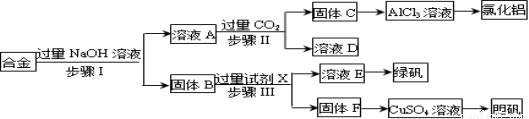
请回答:
【制备无水氯化铝】
(1)步骤Ⅰ进行的实验操作所需要的玻璃仪器是 ;
(2)步骤Ⅱ生成固体C的离子方程式是 ;
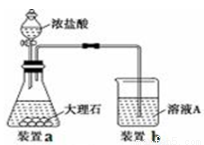
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 ;
(4)由AlCl3溶液制备无水AlCl3的实验过程如下:
①由AlCl3溶液制备氯化铝晶体(AlCl3•6H2O)涉及的操作为: 、冷却结晶、过滤、洗涤;
②将AlCl3•6H2O溶于浓硫酸进行蒸馏,可以得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母)。
a.氧化性 b.吸水性 c.难挥发性 d.脱水性
【制备胆矾晶体】
(5)用固体F制备CuSO4溶液,可设计以下三种途径,你认为的最佳途径为 。(填序号)

【测定FeSO4•7H2O含量】
(6)称取制得的绿矾样品10.0 g,溶于适量的稀硫酸中,配成100 mL溶液,准确量取2 5.00 mL该液体于锥形瓶中,再用0.1000 mol/L KMnO4标准溶液滴定。用同样的方法滴定3次,平均消耗15.00 mL标准液,则样品中FeSO4•7H2O的质量分数为 。(已知Mr(FeSO4·7H2O)=278)
5.00 mL该液体于锥形瓶中,再用0.1000 mol/L KMnO4标准溶液滴定。用同样的方法滴定3次,平均消耗15.00 mL标准液,则样品中FeSO4•7H2O的质量分数为 。(已知Mr(FeSO4·7H2O)=278)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则一中高二6月月考化学试卷(解析版) 题型:选择题
下列气体遇到空气时,会发生颜色变化的是
A.N2 B.NH3 C.CO2 D.NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com