
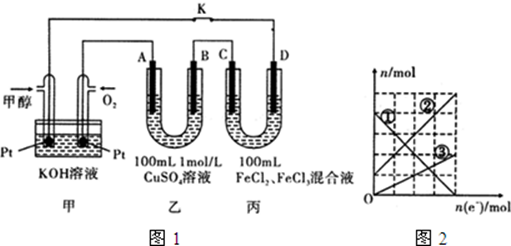
分析 (1)A与燃料电池的正极相连,所以A是阳极;甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,注意电解质溶液是碱性溶液;
(2)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气;A电极为阳极,溶液中的氢氧根离子失电子生成氧气;阳极电极反应和电子守恒计算得到;
(3)A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:4OH--4e-=2H2O+O2↑;
(4)C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子;反应结束后铁元素全部转化为亚铁,所以滴加2.0mol•L-1NaOH溶液得氢氧化亚铁,过滤,将滤液蒸干过程中氢氧化亚铁易被氧化成氢氧化铁,据B电子转移的物质的量应该为0.4mol,生成Cu2+应为0.2mol,横轴,纵轴每个单位都是0.1mol,且此时溶液中铜离子0.2mol,三价铁离子无,亚铁离子根据图象总量应为0.5mol,所以氢氧化铁的物质的量为0.5mol,所以质量为:0.5×107=53.5g.
解答 解:(1)A与燃料电池的正极相连,所以A是阳极;甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:阳极;CH3OH-6e-+8OH-=CO32-+6H2O;
(2)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4x x
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,
故答案为:0.1mol;
(3)A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(4)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,反应结束后铁元素全部转化为亚铁,所以滴加2.0mol•L-1NaOH溶液得氢氧化亚铁,过滤,将滤液蒸干过程中氢氧化亚铁易被氧化成氢氧化铁,据B电子转移的物质的量应该为0.4mol,生成Cu2+应为0.2mol,横轴,纵轴每个单位都是0.1mol,且此时溶液中铜离子0.2mol,三价铁离子无,亚铁离子根据图象总量应为0.5mol,所以氢氧化铁的物质的量为0.5mol,所以质量为:0.5×107=53.5g,氢氧化铜的物质的量为0.2mol,所以质量为:0.2×98=19.6g,所以固体的质量为19.6g+53.5g=73.1g,故答案为:Fe3+;73.1g.
点评 本题综合原电池电解原理以及原电池知识,综合性强,题目难度中等,主要考查学生分析问题和解决问题的能力,是高考的热点习题,注意电子守恒的应用.


科目:高中化学 来源: 题型:选择题
| A. | 1:2:1 | B. | 3:3:1 | C. | 7:7:9 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | C+H2O═CO+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2,3-二甲基戊烷
2,3-二甲基戊烷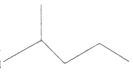 表示的分子式C6H14;
表示的分子式C6H14;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的物质的量,盐酸大于醋酸 | |
| B. | 分别于锌反应,产生H2的物质的量不一定相等 | |
| C. | 分别于镁反应,反应速率盐酸大于醋酸 | |
| D. | H+的物质的量浓度,盐酸大于醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中由水电离出的c(H+)为1.0×10-3mol/L | |
| B. | 在Na2A、NaHA两种溶液中,离子种类不同 | |
| C. | 在NaHA溶液中一定有c(OH-)+c(HA-)+2c(A2-)═c(Na+)+c(H+) | |
| D. | 在Na2A溶液中,c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钙溶液与少量碳酸氢镁溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| C. | Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 硫酸亚铁的酸性溶液中加入H2O2溶液:Fe2++H2O2+2H+═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最经固体材料,可用作处理海上原油泄漏的吸油材料 | |
| B. | 过氧化氢酶、酚醛树脂、尼龙、有机玻璃、PVC都是高分子化合物 | |
| C. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| D. | 电解熔融氧化铝、粗硅的制取涉及化学变化,煤焦油中提取苯是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com