
| A. | Cu | B. | CO2 | C. | NH4Cl | D. | NH3•H2O |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、金属氧化物和水;
在水溶液里和熔融状态下都不导电的化合物是非电解质,包括非金属氧化物、部分非金属氢化物、大多数有机物;
单质和混合物既不是电解质,也不是非电解质;
部分电离的电解质属于弱电解质,完全电离的电解质属于强电解质.
解答 解:A、金属铜为单质,既不是电解质也不是非电解质,故A错误;
B、二氧化碳在水溶液中和熔融状态下均不能导电,故为非电解质,故B错误;
C、氯化铵在水溶液中能完全电离而导电,故为强电解质,故C错误;
D、一水合氨在水溶液中能部分电离而导电,故为弱电解质,故D正确.
故选D.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断,题目难度不大,注意掌握电解质与非电解质、强电解质与弱电解质的本质区别,试题能够培养学生灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液操作时,先将分液漏斗中的下层液体放出,再将上层液体接着放出 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 蒸馏实验中温度计的水银球应插入液态混合物中 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层滤纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
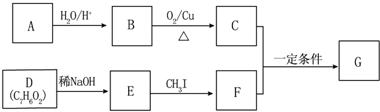
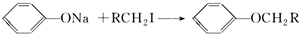
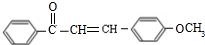 (不要求立体异构).
(不要求立体异构).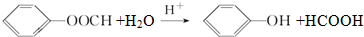 .
.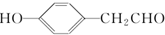 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 9.1% | C. | 1% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 小于0.6 mol | ||
| C. | 大于0.6 mol | D. | 大于0.3 mol,小于0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com