
能鉴别Na2SiO3、CaCO3、SiO2三种白色粉末的试剂是( )
A.苛性钠溶液 B.水
C.NaCl溶液 D.稀盐酸
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 锥形瓶可用作加热的反应器 |
|
| B. | 室温下,不能将浓硫酸盛放在铁桶中 |
|
| C. | 配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高 |
|
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾:
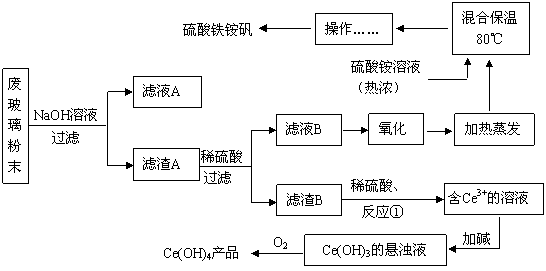
已知:
Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸;
Ⅲ.硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理。
(1)滤液A的主要成分 (填写化学式)。
(2)写出反应①的离子方程式 。
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是
。
(4)稀土元素的提纯,还可采用萃取法。已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
 |
所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质
量分数 。(填“偏大”、“偏小”或“无影响”)
(6)已知Fe3+沉淀的pH范围:2.2~3.2,Fe2+沉淀的pH范围:5.8~7.9,Zn2+沉淀的pH范围:5.8~11.0,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。现用FeSO4溶液(含有ZnSO4杂质)来制备硫酸铁铵矾。实验中可选用的试剂: KMnO4溶液、30%H2O2、 NaOH溶液、饱和石灰水、稀H2SO4溶液、稀盐酸。
实验步骤依次为:
①向含有ZnSO4杂质的FeSO4溶液中,加入足量的NaOH溶液至pH>11, ;
② ;
③向②中得到的溶液中加入硫酸铵溶液, ,过滤、洗涤、常温晾干,得硫酸铁铵晶体(NH4) Fe(SO4)2·12H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对可逆反应2X(g) + Y(g) 3Z(g) + W(s) ΔH>0 的叙述正确的是( )
A.加入少量W,逆反应速率增大,平衡向左移动
B.增大压强,正反应速率增大,逆反应速率减小
C.温度、体积不变,充入He气增大压强,反应速率会加快
 D.升高温度,混合气体的平均相对分子质量减小
D.升高温度,混合气体的平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均为可溶于水的固体,组成他们的离子有
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 | OH- C |
分别取它们的水溶液进行实验,结果如下:①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)据此推断它们是(写化学式)A ;B ;C ;D ;E 。
(2)写出④中反应的离子方程式: 。
(3) A溶液中各种离子浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一无色透明的溶液做如下实验:
①取少量溶液滴加盐酸酸化的BaCl2溶液,有白色沉淀生成。
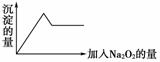
②另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示,试问:
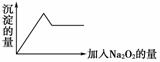
(1)Cu2+、NH 、Al3+、Mg2+、Na+、Fe3+、CO
、Al3+、Mg2+、Na+、Fe3+、CO 、K+、SO
、K+、SO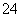 等离子中一定存在的离子是________;可能存在的离子是________;一定不存在的离子是________。
等离子中一定存在的离子是________;可能存在的离子是________;一定不存在的离子是________。
(2)上述溶液至少由________等物质混合而成。
查看答案和解析>>
科目:高中化学 来源: 题型:
一无色透明的溶液做如下实验:
①取少量溶液滴加盐酸酸化的BaCl2溶液,有白色沉淀生成。
②另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示,试问:
(1)Cu2+、NH 、Al3+、Mg2+、Na+、Fe3+、CO
、Al3+、Mg2+、Na+、Fe3+、CO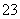 、K+、SO
、K+、SO 等离子中一定存在的离子是________;可能存在的离子是________;一定不存在的离子是________。
等离子中一定存在的离子是________;可能存在的离子是________;一定不存在的离子是________。
(2)上述溶液至少由________等物质混合而成。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数,下列说法中正确的是( )
|
| A. | 1mol Al3+含有的核外电子数为3NA |
|
| B. | 将58.5g NaCl溶于1.00L水中,所得NaCl溶液的浓度为1.00mol•L﹣1 |
|
| C. | 1mol Cl2与足量的铁反应,转移的电子数为3NA |
|
| D. | 常温下,10L pH=1的硫酸溶液中含有的H+离子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com