
分析 转移电子的物质的量=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}/mol}$=0.1mol,
(1)阳极上氯离子放电生成氯气,根据氯气和转移电子之间关系式计算氯气体积;
(2)根据化学式知,X化合价为+2价,根据转移电子知,金属n=$\frac{0.1mol}{2}$=0.05mol,M=$\frac{m}{n}$得X摩尔质量,在数值上等于其相对原子质量.
解答 解:转移电子的物质的量=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}/mol}$=0.1mol,
(1)阳极上氯离子放电生成氯气,根据氯气和转移电子之间关系式得氯气体积=$\frac{0.1mol}{2}×22.4L/mol$=1.12L,答:标况下产生气体体积为1.12L;
(2)根据化学式知,X化合价为+2价,根据转移电子知,金属n=$\frac{0.1mol}{2}$=0.05mol,M=$\frac{m}{n}$=$\frac{3.2g}{0.05mol}$=64g/mol,在数值上等于其相对原子质量为64,答:该金属的相对原子质量为64.
点评 本题以电解原理为载体考查物质的量有关计算,为高频考点,明确各个物理量关系是解本题关键,熟悉各个物理量之间的换算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═2HCO3-+H2SiO3↓ | |
| B. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(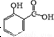 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
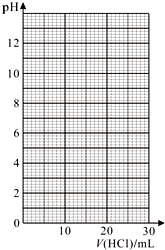 化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 |
| V(HCl)/mL | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 | |
| pH | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ①④⑥ | C. | ①⑤ | D. | ①⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 灯泡最暗时溶液中无自由移动的离子 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com