
����ָ����Ӧ�����ӷ���ʽ��ȷ���ǣ���
A���Ȼ�����Һ�м�������İ�ˮ��Al3++4 NH3��H2O��AlO2��+4 NH4+
B��ϡ�����м���������ۣ�Fe+4H++NO3�� = Fe3++NO��+2H2O
C������������Ũ�����ϼ��ȣ�MnO2+4H++2Cl�� �� Mn2++ Cl2��+2H2O
D��ʯ��ˮ�м������С�մ���Һ��HCO3��+Ca2++OH����CaCO3��+H2O
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������ѧ�ڵ�һ�ν��Լ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���Ӧ���У������˹�Ԫ�صĻ�ԭ�Ե���
A���ù����켯�ɵ�·������ܵȰ뵼������
B����Ұ�⣬�ù衢ʯ�ҡ��ռ�Ļ������ȡ������Si + Ca (OH)2 + 2NaOH = Na2SiO3 + CaO +2H2��
C����HF���ʴ������SiO2+4HF=SiF4��+2H2O
D�����ʹ���Ʊ��� SiO2 + 2C Si + 2CO��
Si + 2CO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������ѧ�ڵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ���� �� ��
A��NaCl��Һ���磬����NaCl��Һ�ǵ���ʣ�
B��Cu�ܵ��磬����Cu�ǵ���ʣ�
C��SO3����ˮ�ܵ��磬����SO3�ǵ���ʣ�
D��Һ̬�ƾ����ƾ���ˮ��Һ�����磬���Ծƾ��Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ��ѧ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
��16�֣�ClO2�ڳ�������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ��59�棬�е�Ϊ11.0�棬������ˮ����ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶá�ijѧ������ͼ1��ʾװ��ģ�ҵ��ȡ���ռ�ClO2��
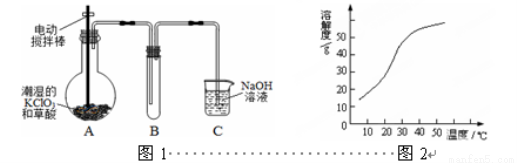
��1��Aװ�õ綯������������� ��Aװ�ñ��������¶ȿ���װ�ã����ƾ����⣬����Ҫ�IJ����������ձ��� ��
��2��Bװ�ñ�����ڱ�ˮԡ�У���ԭ���� ��
��3����Ӧ����װ��C�пɵ�NaClO2��Һ����֪��1��NaClO2������Һ���¶ȵ���38��ʱ����������NaClO2��3H2O�����¶ȸ���38��ʱ����������NaClO2���¶ȸ���60��ʱNaClO2�ֽ�����NaClO3��NaCl����2��NaClO2���ܽ��������ͼ2��ʾ���벹���NaClO2��Һ���Ƶ�NaClO2����IJ������裺
�ټ�ѹ��55�������ᾧ���� ���� ���ܵ���60�����õ���Ʒ��
��4��ClO2�ܲ��ȶ������������ƣ�������ˮ���յõ�ClO2��Һ��Ϊ�ⶨ������Һ��ClO2�ĺ���������������ʵ�飺
����1��ȷ��ȡClO2��Һ10.00 mL��ϡ�ͳ�100.00 mL��������ȡV1 mL�������뵽��ƿ�У�
����2����ϡ�������������pH��2.0������������KI���壬����Ƭ�̣�
����3������ָʾ������c mol��L-1 Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��ҺV2 mL����֪2 Na2S2O3 + I2 ��Na2S4O6 + 2NaI����
������100 mL c mol��L-1 Na2S2O3����Һʱ���õ��IJ����������ձ�����Ͳ����������У� ��
�ڵζ������н�������ƽ�вⶨ��ԭ���� ��
�����ζ�ǰ�ζ��ܼ����������ݣ��ζ���������ʧ����ⶨ��� �����ƫ�ߡ�����ƫ�͡����䡱 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ��ѧ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�л���X�Ľṹ��ʽ����ͼ��ʾ���������й�˵������ȷ���� �� ��
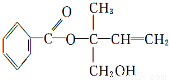
A��X�ķ���ʽΪC12H16O3
B��X��һ���������ܷ����ӳɡ��Ӿۡ�ȡ������ȥ�ȷ�Ӧ
C����Ni�������������£�1 mol X���ֻ����1 mol H2�ӳ�
D���������Ը��������Һ���ֱ���X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ��ѧ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ�����ʾ��ȷ���� ����
A���������ױ��Ľṹ��ʽ��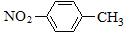
B�Ȼ�淋ĵ���ʽ��
C��������Ϊ16����ԭ�ӣ�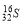
D����Ȳ�����ʽ��CH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ����9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ���ǣ� ��
A���������еμӰ�ˮ��H+ + OH- = H2O
B��Fe(OH)3��������Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C��ͭ����ϡ���3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ��+ 4H2O
D�� ��Һ��
��Һ�� ��Һ��ϣ�
��Һ��ϣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭���ϲ����и���11�·��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ��װ�ý�����Ӧ��ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
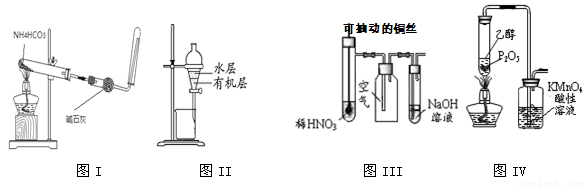
A��ͼI��ʾװ��������ȡ�����İ���
B��ͼII��ʾװ��������ȡI2��CCl4��Һ�е�I2
C��ͼIII��ʾװ����ϡHNO3���ڹ��ƿ�п��ռ�NO����
D��ͼIV��ʾװ�ÿ���ȡ��ϩ����֤���ױ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�γ��и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������ص�������Ľṹ��ʽ��ͼ�������йظ��л������ʵ�˵����ȷ����
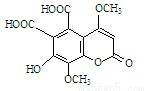
A������FeCl3��Һ������ɫ��Ӧ
B��1mol���л���������3molH2�ӳ�
C��1mol���л��������뺬5molNaOH����Һ��Ӧ
D��1mol���л���������NaHCO3��Һ��Ӧ�ɷų�3molCO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com