
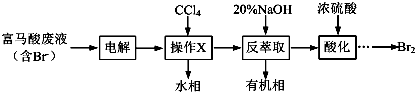

·ÖĪö ø»ĀķĖį·ĻŅŗÖŠŗ¬ÓŠBr-£¬µē½āÉś³Éäåµ„ÖŹ£¬¼ÓČėĖÄĀČ»ÆĢ¼ŻĶČ”ŗó·ÖŅŗ£¬ŌŁ¼ÓČėĒāŃõ»ÆÄĘ·“ŻĶČ”µĆµ½ŗ¬ŠŽĮ¶ÕßŗĶ“ĪäåĖįøłĄė×ÓµÄČÜŅŗ£¬¼ÓČėĮņĖįĖį»Æ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³Éäåµ„ÖŹ£»
£Ø1£©²Ł×÷XĪŖŻĶČ”·ÖŅŗ£¬ŠčŅŖÉÕ±”¢·ÖŅŗĀ©¶·µČŅĒĘ÷£»·“ŻĶČ”Ź±¼ÓČė20%µÄNaOHČÜŅŗ·“Ӧɜ³Éäå»ÆÄĘ”¢“ĪäåĖįÄĘŗĶĖ®£»
£Ø2£©äåµ„ÖŹŅ×»Ó·¢£¬ÅØĮņĖįČܽā·ÅČČ·ÖĪö£»
£Ø3£©ĪŽÓŠ¶¾ĘųĢåĀČĘų²Ī¼Ó·“Ó¦£¬Éś²ś¹ż³Ģ»·±££»
£Ø4£©¢ŁĮņ“śĮņĖįÄĘČÜŅŗµĪ¶Øµāµ„ÖŹ£¬¼ÓČėµķ·ŪČÜŅŗ×öÖøŹ¾¼Į£»
¢ŚŅĄ¾Ż»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖć£»
¢Ū²½Öč3³ÖŠųµÄŹ±¼ä³¤µ¼ÖĀµÄŹĒKI±»Ńõ»Æ£®
½ā“š ½ā£ŗø»ĀķĖį·ĻŅŗÖŠŗ¬ÓŠBr-£¬µē½āÉś³Éäåµ„ÖŹ£¬¼ÓČėĖÄĀČ»ÆĢ¼ŻĶČ”ŗó·ÖŅŗ£¬ŌŁ¼ÓČėĒāŃõ»ÆÄĘ·“ŻĶČ”µĆµ½ŗ¬ŠŽĮ¶ÕßŗĶ“ĪäåĖįøłĄė×ÓµÄČÜŅŗ£¬¼ÓČėĮņĖįĖį»Æ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³Éäåµ„ÖŹ£»
£Ø1£©²Ł×÷XĪŖŻĶČ”·ÖŅŗ£¬ŠčŅŖÉÕ±”¢·ÖŅŗĀ©¶·µČŅĒĘ÷£»·“ŻĶČ”Ź±¼ÓČė20%µÄNaOHČÜŅŗ·“Ӧɜ³Éäå»ÆÄĘ”¢“ĪäåĖįÄĘŗĶĖ®£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗBr2+2OH-=Br-+BrO-+H2O£»
¹Ź“š°øĪŖ£ŗ·ÖŅŗĀ©¶·£»Br2+2OH-=Br-+BrO-+H2O£»
£Ø2£©äåµ„ÖŹŅ×»Ó·¢£¬ÅØĮņĖįČܽā·ÅČČ·ÖĪö£¬·“ŻĶČ”ĖłµĆĖ®ĻąĖį»ÆŹ±£¬Šč»ŗĀż¼ÓČėÅØĮņĖį£¬²¢²ÉÓƱłĖ®Ō”ĄäČ“µÄŌŅņŹĒ¼õÉŁäåµ„ÖŹµÄ»Ó·¢£»
¹Ź“š°øĪŖ£ŗ¼õÉŁBr2µÄ»Ó·¢£»
£Ø3£©ĪŽÓŠ¶¾ĘųĢåĀČĘų²Ī¼Ó·“Ó¦£¬Éś²ś¹ż³Ģ»·±££»
¹Ź“š°øĪŖ£ŗƻӊ²ÉÓĆÓŠ¶¾ĘųĢåCl2£¬øü»·±££»
£Ø4£©¢ŁĮņ“śĮņĖįÄĘČÜŅŗµĪ¶Øµāµ„ÖŹ£¬¼ÓČėµķ·ŪČÜŅŗ×öÖøŹ¾¼Į£»µĪČė2”«3µĪµķ·ŪČÜŅŗ£¬ŌŁÓĆ0.01mol/L Na2S2O3±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµć£»
¹Ź“š°øĪŖ£»µĪČė2”«3µĪµķ·ŪČÜŅŗ£»
¢ŚŅĄ¾Ż»Æѧ·½³ĢŹ½¶ØĮæ¹ŲĻµ¼ĘĖć£¬½«4.5mL 0.02mol/LäåĖ®ŃøĖŁ¼ÓČėµ½×¶ŠĪĘæÖŠ£¬n£ØBr2£©=0.0045L”Į0.02mol/L=0.00009mol£¬ĘäÖŠŗĶµā»Æ¼Ų·“Ó¦µÄäåµ„ÖŹĪļÖŹµÄĮæ
2KI”«Br2”«I2”«2Na2S2O3£¬£»
1 2
n 0.01mol/L”Į0.015L
n=0.000075mol
Óė±½·Ó·“Ó¦µÄäåµ„ÖŹ=0.00009mol-0.000075mol=0.000015mol
Ōņ±½·ÓĪļÖŹµÄĮæ=$\frac{1}{3}$”Į0.000015mol=0.000005mol
øĆ·ĻĖ®ÖŠ±½·ÓµÄŗ¬ĮæĪŖ=$\frac{1000ml}{25ml}$”Į0.000005mol”Į94g/mol=0.0188g/L=18.8mg/L£»
¢Ū²½Öč3³ÖŠųµÄŹ±¼ä³¤µ¼ÖĀµÄŹĒKI±»Ńõ»Æ£¬²ā¶Ø±½·ÓĮæ¼õÉŁ£¬²ā¶Ø½į¹ūĘ«µĶ£»
¹Ź“š°øĪŖ£ŗĘ«µĶ£®
µćĘĄ ±¾Ģāæ¼²éĮĖ·ĻĖ®ÖŠĪļÖŹŗ¬ĮæµÄ²ā¶ØŹµŃéĢ½¾æŗĶĪļÖŹŠŌÖŹµÄ·ÖĪöÅŠ¶Ļ£¬×¢ŅāµĪ¶ØŹµŃéµÄ¹ż³Ģ·ÖĪöÓ¦ÓĆ£¬ÕĘĪÕ»ł“”ŹĒ¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĘÄĻŹ¦“óø½Š”Ņ»ĻßĆūŹ¦ĢįÓÅ×÷ŅµĻµĮŠ“š°ø
ŌĘÄĻŹ¦“óø½Š”Ņ»ĻßĆūŹ¦ĢįÓÅ×÷ŅµĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ·“Ó¦ | ”÷H/kJ•mol-1 | ”÷S/J•K-1•mol-1 |
| ¢Ł | -72.1 | +220 |
| ¢Ś | +149 | +41 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Q3-Q2+3 Q1 | B£® | Q3+Q2+Q1 | C£® | 3Q3-Q2+Q1 | D£® | Q2-Q3+3 Q1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ö»ÓŠPCl5 | B£® | Ö»ÓŠPCl3 | ||
| C£® | Ö»ÓŠCl2 | D£® | ŅŌÉĻČżÖÖĪļÖŹ¶¼ÓŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | XY3 | B£® | XY | C£® | X3Y | D£® | X2Y3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Õńµ“·ÖŅŗĀ©¶·Ź±Ó¦¹Ų±ÕĘä²£Į§ČūŗĶ»īČū | |
| B£® | µĪ¶Ø¹Ü×°ŅŗµĪ¶ØŹ±Ó¦ĻČÓƱź×¼ČÜŅŗČóĻ“ | |
| C£® | ÕōĮóŹ±ĪĀ¶Č¼ĘµÄĖ®ŅųĒņ“¦ÓŚÕōĮóÉÕĘæÖ§¹Üø½½ü | |
| D£® | ׶ŠĪĘæÓĆ×÷·“ӦȯĘ÷Ź±£¬Ņ»¶Ø²»ÄܼÓČČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H+”¢MnO4-”¢Na+”¢Cl- | B£® | K+”¢Fe2+”¢NO3-”¢HCO3- | ||
| C£® | Na+”¢K+”¢NO3-”¢SO42- | D£® | Fe3+”¢Na+”¢Cl-”¢SO42- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com