
【题目】【化学—选修5有机化学基础】
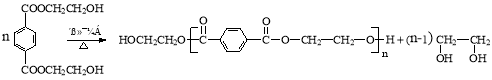
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ. RCOOR’+ R”18OH![]() RCO18OR”+R’OH(R、R’、R”代表烃基)
RCO18OR”+R’OH(R、R’、R”代表烃基)
![]()
![]() Ⅱ.
Ⅱ.  (R、R’代表烃基)
(R、R’代表烃基)
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d. 1 mol 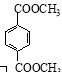 与足量NaOH溶液反应时,最多消耗4 mol NaOH[
与足量NaOH溶液反应时,最多消耗4 mol NaOH[
(7)写出由PET单体制备PET聚酯并生成B的化学方程式________。
【答案】(1)加成反应 (2)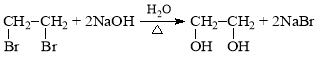
(3)碳碳双键 酯基 (4)![]()
(5) (6)a、c
(6)a、c
(7)
【解析】
试题分析:乙烯发生加成反应生成BrCH2CH2Br(A),A与NaOH溶液加热发生取代反应生成B,B为HOCH2CH2OH,PET单体含有12个碳原子,结合信息Ⅰ可知PET单体为![]() D为CH3OH,由PMMA可推知单体为CH2=C(CH3)COOCH3,则J为CH2=C(CH3)COOH,G为(CH3)2C(OH)COOH,由信息Ⅱ可知F为丙酮。
D为CH3OH,由PMMA可推知单体为CH2=C(CH3)COOCH3,则J为CH2=C(CH3)COOH,G为(CH3)2C(OH)COOH,由信息Ⅱ可知F为丙酮。
(1)根据上述推断,①的反应类型是加成反应。
(2)根据上述分析,②是溴代烃在NaOH溶液中发生取代反应生成醇的过程,则反应的化学方程式为 。
。
(3)根据上述分析,PMMA单体为CH2=C(CH3)COOCH3,含有的官能团名称是碳碳双键、酯基。
(4)F的核磁共振氢谱显示只有一组峰,F为丙酮,则E为醇,在铜作催化剂、加热的条件下生成丙酮,则E为2-丙醇,2-丙醇的催化氧化反应方程式为![]() 。
。
(5)根据上述分析,G的结构简式为![]() 。
。
(6)反应⑦为CH2=C(CH3)COOH与CH3OH的酯化反应,a项正确;B、D官能团的数目不同,不是同系物,b项错误;CH3OH呈液态,CH4呈气态,c项正确;1 mol ![]() 与足量NaOH溶液反应时,最多消耗2 mol NaOH,d项错误;答案选ac。
与足量NaOH溶液反应时,最多消耗2 mol NaOH,d项错误;答案选ac。
(7)由PET单体制备PET聚酯并生成B的化学方程式为:



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O == BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
体系 pH | 不同温度下的半衰期(min) | |||
0℃ | 25℃ | 50℃ | 75℃ | |
8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。

温度较低时主要反应①:N2H4 + O2 ![]() N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 ![]() 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
(4)若反应①在250℃时的平衡常数为K1,350℃时的平衡常数为K2,则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中![]() 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气
B.增大容器体积
C.恒容条件下,充入N2H4
D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来, 科学家研制了一种新型的乙醇电池(DEFC), 它用磺酸类质子作溶剂, 在200℃左右时供电, 乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为: C2H5OH+3O2 ![]() 2CO2+3H2O。下列说法不正确的是
2CO2+3H2O。下列说法不正确的是
A.C2H5OH在电池的负极上参加反应 B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极 D.电池正极得电子的物质是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:
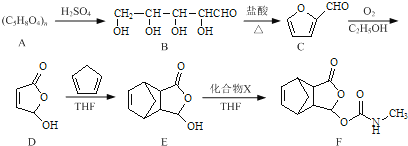
(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2 化学与技术】
Ⅰ.下列有关叙述正确的是( )
A.碱性锌锰电池中,MnO2是催化剂
B.银锌纽扣电池工作时,Ag2O被还原为Ag
C.放电时,铅酸蓄电池中硫酸浓度不断增大
D.电镀时,待镀的金属制品表面发生还原反应
Ⅱ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的 操作。
(3)浸出液“净化”过程中加入的主要物质为 ,其作用是 。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气是 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为 。
(6)我国古代曾采用“火法”工艺冶炼锌,明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业上常用下列方法制备H2:
方法①:C(s)+2H2O(g)![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJmol-1
②2C(石墨)+O2(g)═2CO2(g)△H=-222kJmol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJmol-1
试计算25℃时由方法②制备1000gH2所放出的能量为______kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:

①T1______T2(填“>”、“=”或“<”);T1℃时,该反应的平衡常数K=______。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是______。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是________________________,从t1到t8哪个时间段H2O(g)的平衡转化率最低______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是__________ _____,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应X+Y=Z的能量变化情况,某同学设计了如图所示装置。当向盛有X的试管中滴加试剂Y时,看到U型管中甲处液面下降乙处液面上升。试回答下列问题:
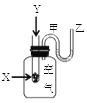
(1)该反应为______反应(填“放热”或“吸热”)。
(2)X和Y的总能量比Z的总能量_______(填“高”或“低”)。
(3)物质中的化学能通过_____转化成_______释放出来。
(4)反应物化学键断裂吸收的能量____于生成物化学键形成放出的能量(填“高”或“低”)。
(5)己知2mol氢气完全燃烧生成水蒸气时放出能量484kJ,且氧气中1molO=O键完全断裂时吸收能量496kJ,水蒸气中1molH-O键形成时放出能量463kJ,则氢气中1molH-H键断裂时吸收能量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如下图所示装置进行有关实验。

(1)装置A中发生反应的化学方程式为____________________________。
(2)装置D中试管口放置的棉花应浸一种溶液,这种溶液是________,其作用是________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_______________,
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com