
【题目】I.下列实验可达到实验目的的是(______)
A、将![]() 与浓硫酸共热制备CH3—CH=CH2
与浓硫酸共热制备CH3—CH=CH2
B、向CH3CH2Br中滴入AgNO3水溶液可以检验溴元素
C、![]() 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备![]()
D、用溴水即可检验CH2=CH—CHO中的碳碳双键
II.氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:回答下列问题:

(1)A的结构简式为____________。
(2)③的反应试剂是____________________,该反应的类型是__________。
(3)⑤的反应方程式为___________________________________________。吡啶是一种有机碱性溶剂,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
【答案】A ![]() 浓HNO3/浓H2SO4 取代反应
浓HNO3/浓H2SO4 取代反应 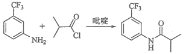 +HCl 吸收反应产生的HCl,提高反应转化率 C11H11F3N2O3 9
+HCl 吸收反应产生的HCl,提高反应转化率 C11H11F3N2O3 9 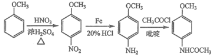
【解析】
I.A.与-OH相连的C的邻位C上有H原子,能发生消去反应,醇的消去反应条件为浓硫酸并加热;
B. CH3CH2Br为非电解质,不能发生电离;
C. 酚-OH与NaHCO3溶液不反应;
D.C=C、-CHO均能与溴水反应。
II. 由C倒推B与A,可知反应②为3个氟原子取代氯原子,而反应①为3个氯原子取代氢原子,所以A为甲苯,反应③为硝化反应,反应⑤发生取代反应,据此分析。
I.A.![]() 分子中与-OH相连的C的邻位C上有H原子,能发生消去反应,醇的消去反应条件为浓硫酸并加热,反应条件合理,能实现,所以A选项是正确的;
分子中与-OH相连的C的邻位C上有H原子,能发生消去反应,醇的消去反应条件为浓硫酸并加热,反应条件合理,能实现,所以A选项是正确的;
B. CH3CH2Br为非电解质,不能发生电离,则不能直接加入硝酸银检验,应先在碱性条件下水解,加入硝酸酸化后再加入硝酸银溶液检验,故B错误;
C. 羧基酸性比碳酸强,可与碳酸氢钠反应,而酚羟基酸性比碳酸弱,与碳酸氢钠不反应,则乙酰水杨酸![]() 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备![]() ,故C错误;
,故C错误;
D.C=C、-CHO均能与溴水反应,则用溴水不能检验CH2=CH—CHO中的碳碳双键,应先排除-CHO的干扰,不能实现,故D错误。
所以A选项是正确的。
II.(1)由C倒推B与A,可知反应②为3个氟原子取代氯原子,而反应①为3个氯原子取代氢原子,所以A为甲苯,结构简式为![]() ;
;
故答案为:![]() ;
;
(2)反应③为硝化反应,反应试剂为浓HNO3/浓H2SO4,反应条件为加热;该反应属于取代反应,
故答案为:浓HNO3/浓H2SO4 ;取代反应;
(3)根据G的结构简式,反应⑤发生取代反应,反应方程式为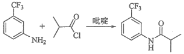 ,反应中生成有HCl,吡啶作为有机碱可吸收HCl,促进反应发生,提高反应转化率。
,反应中生成有HCl,吡啶作为有机碱可吸收HCl,促进反应发生,提高反应转化率。
故答案为: +HCl;吸收反应产生的HCl,提高反应转化率;
+HCl;吸收反应产生的HCl,提高反应转化率;
(4)根据G的结构简式,可写出其化学式为C11H11F3N2O3。
故答案为:C11H11F3N2O3;
(5)苯环上存在三种不同取代基,同分异构体数量为10种,除去G本身,H共有9种。
故答案为:9;
(6)根据目标产物和流程图,苯甲醚应首先与混酸反应,在对位上引入硝基,然后在铁和HCl作用下-NO2转化成-NH2,最后在吡啶作用下与CH3COCl反应生成目标产物,合成路线是: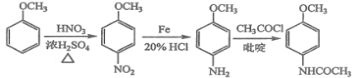 。
。


科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是


A. 装置①用于测定生成氢气的速率
B. 装置②依据褪色快慢比较浓度对反应速率的影响
C. 装置③依据U管两边液面的高低判断Na和水反应的热效应
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示可逆反应 mA(g)+nB(g) ![]() pC(g)+qD(g) 在不同温度(T)和压强(P)下生成物D的体积分数w(D)随时间的变化情况。关于上述正反应的判断正确的是
pC(g)+qD(g) 在不同温度(T)和压强(P)下生成物D的体积分数w(D)随时间的变化情况。关于上述正反应的判断正确的是


A. T1>T2 ,△H<0 B. T2>T1 ,△H>0
C. P2>P1 ,m+n>p+q D. P1>P2 ,m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol H2SO4 的质量为98 g·mol-1B. 98 g H2SO4含有NA个H2SO4分子
C. H2SO4的摩尔质量为98 gD. 6.02×1023个H2SO4分子的质量为9.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数大于4的主族元素Xm+、Yn-的离子核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数 B. X、Y的核电荷数之差是(m-n)
C. X和Y处于同一周期 D. Y元素与X元素的族序数之差是8-(m+n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行下列实验,能达到实验目的的是
溶液a | 固体b | 溶液c | 实验目的:验证 |
| |
A | 浓硝酸 | NaHCO3 | Na2SiO3 | 非金属性:N>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓盐酸 | CaCO3 | NaAlO2 | 酸性:HCl>H2CO3>Al(OH)3 | |
D | 浓氨水 | CaO | 酚酞溶液 | NH3·H2O是弱碱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾的化合物广泛存在于自然界中。回答下列问题:
(l)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_________形象化描述。
(2)钾的焰色反应为_____色,发生焰色反应的原因是__________________________________。
(3)叠氮化钾(KN3)晶体中,含有的共价键类型有_____________,N3-的空间构型为__________。
(4)CO能与金属K和Mn形成配合物K[Mn(CO)5],Mn元素基态原子的价电子排布式为______________。
(5)原子坐标参数可表示晶饱内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数A(0,0,0)、B(l,0,0),则C原子的坐标参数为_____________。

(6)钾晶体的晶胞参数为a pm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为____________pm,晶体钾的密度计算式是_____________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com