
 化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.
化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.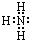 .
.分析 D元素是地壳中含量仅次于氧的非金属元素,则D为Si,化合物A是制玻璃的主要原料之一,且能在在高温下与碳反应生成气体B与D的单质,B不溶于水,则A为SiO2,B为CO.D的单质与Cl2反应生成F为SiCl4,气体H的水溶液呈碱性,则H为NH3,I的水溶液呈酸性,可知I为HCl,G为NH4Cl,J中含有N、Si两种元素,Si元素的质量分数为60%,则N、Si原子数目之比为$\frac{1-60%}{14}$:$\frac{60%}{28}$=4:3,其相对分子质量为140,则J为Si3N4.
解答 解:D元素是地壳中含量仅次于氧的非金属元素,则D为Si,化合物A是制玻璃的主要原料之一,且能在在高温下与碳反应生成气体B与D的单质,B不溶于水,则A为SiO2,B为CO.D的单质与Cl2反应生成F为SiCl4,气体H的水溶液呈碱性,则H为NH3,I的水溶液呈酸性,可知I为HCl,G为NH4Cl,J中含有N、Si两种元素,Si元素的质量分数为60%,则N、Si原子数目之比为$\frac{1-60%}{14}$:$\frac{60%}{28}$=4:3,其相对分子质量为140,则J为Si3N4.
(1)制玻璃的主要原料有SiO2、Na2CO3和CaCO3,由于二氧化硅能和氢氧化钠反应生成硅酸钠而导致玻璃塞打不开,发生反应为:SiO2+2NaOH=Na2SiO3+H2O,则盛放NaOH溶液的试剂瓶不能用玻璃塞,
故答案为:Na2CO3、CaCO3;SiO2+2NaOH=Na2SiO3+H2O;
(2)D为Si元素,位于周期表第3周期IVA族,故答案为:第3周期IVA族;
(3)H为NH3,为共价化合物,电子式为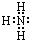 ,故答案为:
,故答案为: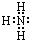 ;
;
(4)由以上分析可知,F和H反应生成J和I反应的化学方程式是:3SiCl4+4NH3$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl,
故答案为:3SiCl4+4NH3$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl;
(5)a.上述由A生成D的单质的反应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO+Si,属于置换反应,故a正确;
b.Si元素在自然界中以化合物形式存在,没有游离态的硅,故b错误;
c.G为NH4Cl,是含有极性共价键的离子化合物,故c正确;
d.HCl和NH4Cl都是强电解质,二者的水溶液都显酸性,故d错误,
故答案为:ac.
点评 本题考查无机物的推断,“A的用途、D元素含量、物质的性质”等是推断突破口,侧重于元素化合物知识的考查,有利于培养学生分析推理能力、知识迁移运用能力.


科目:高中化学 来源: 题型:选择题
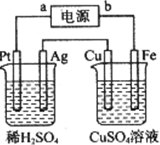
| A. | a极是直流电源的正极 | |
| B. | Fe极是阳极 | |
| C. | Pt极产生的气体体积是Ag极产生气体体积的2倍 | |
| D. | 硫酸铜溶液的浓度变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | 有H2参加反应的b极为电池的正极 | |
| C. | a极对应的电极反应式为O2+2H2O-4e═4OH- | |
| D. | 该电池的总反应方程式为:2H2+O2═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的+1价阳离子的核外有3个电子层且各层均充满.
原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的+1价阳离子的核外有3个电子层且各层均充满.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LNO和NH3的混合气体中,所含氮原子数为2NA | |
| B. | 1molFe粉与1mol水蒸气充分反应转移的电子数为3NA | |
| C. | 某温度下10LpH=11的NaOH溶液中含OH-的数目为NA,该温度下纯水的pH=6 | |
| D. | 含有阴、阳离子总数为1.5NA的NaHSO3溶液,浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1L pH=11的CH3COONa溶液中水电离出的OH-的数目为0.001NA | |
| B. | 28g乙烯和丙烯的混合气体含有的原子个数为3NA | |
| C. | 1mol•L-1 NaHCO3溶液中含有HCO3数目小于NA | |
| D. | 1mol Cl2与足量NaOH溶液反应时转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol HF的体积为22.4 L | |
| B. | 常温常压下,1 mol Na2O2与足量SO2反应,转移电子的数目为NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 探究Na2CO3和NaHCO3的稳定性 | 固体Na2CO3和NaHCO3 | 加热后试管内壁均有水珠,两种物质受热是否分解无法判断 |
| ② | 检验淀粉在硫酸溶液中是否发生水解 | 氢氧化钠、硫酸铜溶液 | 加热后试管底部出现砖红色说明水解过程已发生 |
| ③ | 比较Cl2 与I2的氧化性 | 氯水、淀粉KI试纸 | 试纸变蓝,说明Cl2的氧化性强于I2 |
| ④ | 氧化铝熔点高 | 用砂纸打磨过的铝箔 | 加热后铝熔化并不滴落,好像有层膜兜着,说明氧化铝熔点高. |
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④③⑥①⑤ | B. | ②④③⑥⑤① | C. | ②⑤③⑥①④ | D. | ②⑤①③⑥④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com