
分析 在107.0kPa的压力下,苯-甲苯混合物在369K下沸腾,在该温度下的汽液平衡组成是溶质与溶剂的混合达到的相平衡,根据拉乌尔定律和道尔顿分压定律解答.
解答 解:设苯为A物质,甲苯为B物质,苯的摩尔分数为xA=$\frac{{n}_{A}}{{n}_{A}+{n}_{B}}$,甲苯的摩尔分数为${x}_{B}=\frac{{n}_{B}}{{n}_{A}+{n}_{B}}$=1-xA,
根据拉乌尔定律,苯的分压为${p}_{A}={p}_{A}^{0}{x}_{A}$,甲苯的分压为${p}_{B}={p}_{B}^{0}{x}_{B}$,
根据道尔顿分压定律,p总=pA+pB,
联立,可求得${x}_{A}=\frac{{p}_{总}-{p}_{B}^{0}}{{p}_{A}^{0}-{p}_{B}^{0}}$=$\frac{107.0-65.5}{161.0-65.5}$=0.43,xB=1-xA=0.57,
由道尔顿分压定律,${y}_{A}=\frac{{p}_{A}}{{p}_{总}}=\frac{{p}_{A}^{0}{x}_{A}}{{p}_{总}}$=$\frac{161.0×0.43}{107.0}=0.65$,${y}_{B}=\frac{{p}_{B}}{{p}_{总}}=\frac{{p}_{B}^{0}{x}_{B}}{{p}_{总}}$=$\frac{65.5×0.57}{107.0}$=0.35.
可见平衡相中,含有65%的苯蒸气和35%的甲苯蒸气,
答:含有65%的苯蒸气和35%的甲苯蒸气.
点评 本题考查的是大学化学的化工原理知识,不是高中要求,熟悉拉乌尔定律和道尔顿分压定律是解题的关键.作为大学化学试题来讲,题目较为基础,是基础题.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| B. | 向含1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时的反应:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加少量的稀盐酸:6Br-+2NO3-+8H+=3Br2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极区溶液的pH增大 | |
| B. | 放电时,负极反应式为3Zn-6e-=3Zn2+ | |
| C. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 | |
| D. | 充电时,电池的锌电极接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )| A. | 阴极室发生的反应为2H++2e-=H2↑ | |
| B. | M为阳离子交换膜,N为阴离子交换膜 | |
| C. | 若去掉双极膜(BP),阳极室会有C12生成 | |
| D. | 电路中每转移1mol电子,两极共得到0.5 mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机高分子化合物的相对分子质量很大,但其结构是若干链节的重复 | |
| B. | 生成有机高分子化合物的反应只有加聚反应 | |
| C. | 塑料、合成橡胶和合成纤维这三大合成材料,都主要是以石油、煤和天然气为原料生产的 | |
| D. | 聚乙烯塑料的主要成分聚乙烯是由石油裂解产物乙烯通过聚合反应制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
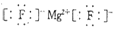 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL 0.1mol/L MgCl2溶液 | B. | 100mL 0.5mol/L AlCl3溶液 | ||
| C. | 50mL1mol/L NaCl溶液 | D. | 25mL 0.5mol/L HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com