
(14分)煤炭气化可以提高燃料的利用率,又可以合成新型能源。
(1)煤炭气化时发生的反应为:C(s)+H2O(g) H2(g)+CO(g)。
H2(g)+CO(g)。
①已知:2C (s)+O2 (g)=2CO (g);△H1=–221.0 kJ mol–1
2H2 (g)+O2 (g)=2H2O (g);△H2=–483.6 kJ mol–1
则煤气化反应的△H= 。
②煤气化反应的平衡常数表达式K= ,温度升高,平衡常数 。
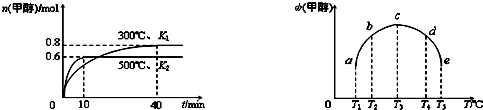
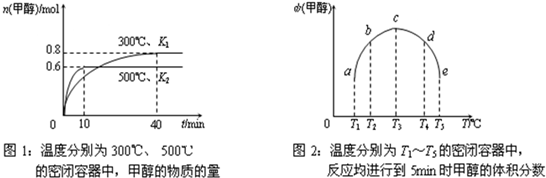
(2)水煤气可以合成甲醇:CO(g)+2H2(g) CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
①从反应开始到平衡,H2的平均反应速率υ(H2)= 。
②反应达平衡后充入适量氢气并维持H2浓度和容器的温度不变,增大容器的体积,跟原平衡相比较达到新平衡时CO的转化率 (填“增大”、“不变”或“减小”),其原因是 。
③将3.2 g甲醇充分燃烧后的产物通入75 mL2 mol/L的NaOH溶液,所得溶液中离子浓度大小顺序为 。
⑴①+131.3 kJ mol–1(2分)
② (2分)
增大 (2分)
(2分)
增大 (2分)
⑵①0.150mol·L-1·min-1(2分) ②不变(2分) 保持温度不变,则平衡常数不变,增大容器体积,维持H2浓度不变,则浓度幂 等于平衡常数K,K不变,所以
等于平衡常数K,K不变,所以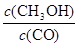 不变,故CO的转化率不变。 (2分)③c(Na+)>c(HCO3-
)>c(CO32 -)>c(OH-)>c(H+) (2分)
不变,故CO的转化率不变。 (2分)③c(Na+)>c(HCO3-
)>c(CO32 -)>c(OH-)>c(H+) (2分)
【解析】⑴①考查盖斯定律的应用。设提供的两个热化学方程式分别为a、b,根据盖斯定律,由(a-b)×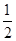 ,可得:C(s)+H2O(g)
,可得:C(s)+H2O(g) H2(g)+CO(g),故△H=(-221+483.6)kJ
mol–1×
H2(g)+CO(g),故△H=(-221+483.6)kJ
mol–1×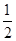 =+131.3 kJ mol–1。
=+131.3 kJ mol–1。
②平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,平衡常数的表达式为K= 。应用正反应是吸热反应,所以升高温度,平衡向正反应方向移动,,因此平衡常数增大。
。应用正反应是吸热反应,所以升高温度,平衡向正反应方向移动,,因此平衡常数增大。
⑵①CO的平衡转化率为75%,所以v(CO)=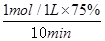 =0.075 mol·L-1·min-1。由于反应速率之比是相应的化学计量数之比,因此v(H2)=2v(CO2)=0.150 mol·L-1·min-1。
=0.075 mol·L-1·min-1。由于反应速率之比是相应的化学计量数之比,因此v(H2)=2v(CO2)=0.150 mol·L-1·min-1。
②保持温度不变,则平衡常数不变,增大容器体积,维持H2浓度不变,则浓度幂 等于平衡常数K,K不变,所以
等于平衡常数K,K不变,所以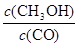 不变,故CO的转化率不变。
不变,故CO的转化率不变。
③3.2g甲醇完全燃烧生成的CO2是3.2g÷32g/mol=0.1mol,氢氧化钠是0.15mol,所以根据方程式可知,反应后得到等物质的量浓度的Na2CO3和NaHCO3溶液,溶液显碱性。由于CO32 -水解程度大于HCO3- 的水解程度,因此离子浓度大小为c(Na+)>c(HCO3- )>c(CO32 -)>c(OH-)>c(H+)。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △H1-△H2 |
| 2 |
| △H1-△H2 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| △H1-△H 2 |
| 2 |
| △H1-△H 2 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012届山东省菏泽学院附中高三5月高考冲刺理科综合化学试卷(带解析) 题型:填空题
(14分)煤炭气化可以提高燃料的利用率,又可以合成新型能源。
(1)煤炭气化时发生的反应为:C(s)+H2O(g) H2(g)+CO(g)。
H2(g)+CO(g)。
①已知:2C (s)+O2(g)=2CO (g);△H1=–221.0 kJ mol–1
2H2(g)+O2(g)=2H2O (g);△H2=–483.6 kJ mol–1
则煤气化反应的△H= 。
②煤气化反应的平衡常数表达式K= ,温度升高,平衡常数 。
(2)水煤气可以合成甲醇:CO(g)+2H2(g) CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
①从反应开始到平衡,H2的平均反应速率υ(H2)= 。
②反应达平衡后充入适量氢气并维持H2浓度和容器的温度不变,增大容器的体积,跟原平衡相比较达到新平衡时CO的转化率 (填“增大”、“不变”或“减小”),其原因是 。
③将3.2 g甲醇充分燃烧后的产物通入75 mL2 mol/L的NaOH溶液,所得溶液中离子浓度大小顺序为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com