
| A. |  系统命名:2-乙基丙烷 系统命名:2-乙基丙烷 | |
| B. | 由分子式为C2H6O组成的物质一定是纯净物 | |
| C. | 正丁烷和异丁烷互为同系物 | |
| D. | 互为同系物的物质,在组成和结构上相似,所以化学性质也相似 |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
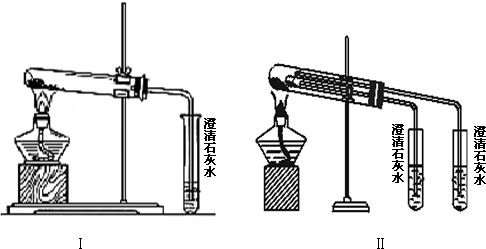
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
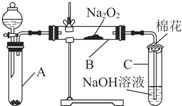 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入1mol•L-1盐酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4, |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3;, |
| 则证明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫红色不褪去, | |
| 则说明生成物中没有Na2SO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
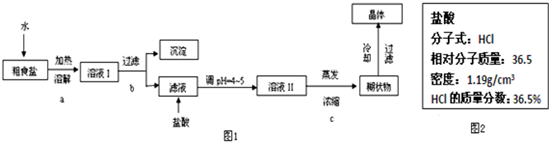
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④ | C. | ①③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸溶液中加入少量Ba(OH)2溶液:SO42-+Ba2+═BaSO4 | |
| C. | 用稀硫酸洗去铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硝酸汞溶液与铝反应:Hg2++Al3+═Al3++Hg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 1 mol NO2和CO2的混合气体中含有的氧原子数为NA | |
| C. | 1.7g H2O2中含有的电子数为0.9NA | |
| D. | 1 mol Al3+离子含有的核外电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com