
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g)△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
分析 A、液态水变为气态水的过程要吸收能量;
B、固体硫燃烧时要先变为气态硫,过程吸热;
C、一氧化碳是碳单质不完全燃烧的产物,完全燃烧时生成二氧化碳,完全燃烧放热更多;
D、热化学方程式中,物质的量越多,伴随的能量变化越大.
解答 解:A、两个反应时都是氢气和氧气生成水,但第一个式子是生成液体,第二个是气态,从气态变为液态还要放出一定的热量,但是Q为负值,所以Q2>Q1,故A错误;
B、固体硫燃烧时要先变为气态硫,过程吸热,则气态硫放出的热量多,但是Q为负值,则Q2>Q1,故B错误;
C、可以很容易地判断出来第二个是完全燃烧反应,第一个是不完全燃烧反应,那么放出的热量很明显是完全燃烧比不完全燃烧放出的多,但是Q为负值,所以Q1>Q2,故C正确;
D、反应的能量变化和反应中各物质的量成正比,故 Q2=$\frac{1}{2}$Q1,但是Q为负值,所以Q2>Q1,故D错误.
故选C.
点评 本题考查反应热的大小比较,题目难度中等,本题注意比较反应热的角度,化学反应中,反应的程度、物质的量以及物质的聚集状态不同,反应放出或吸收的热量是不同的.


科目:高中化学 来源: 题型:解答题



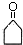 ,G中官能团的名称为酯基、碳碳双键.
,G中官能团的名称为酯基、碳碳双键. +CH3CHO$\stackrel{碱}{→}$
+CH3CHO$\stackrel{碱}{→}$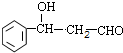 ,反应类型加成反应.
,反应类型加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ]-.
]-.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3→Al(OH)3 | B. | CaCO3→Ca(OH)2 | C. | CH3CH2OH→CH3CHO | D. | CO→Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 位于周期表中第三周期第ⅢA族的元素 | |
| C. | 基态原子最外电子层排布为2s22p6的元素 | |
| D. | 基态原子最外电子层排布为3s23p5的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com