
| A. | pH=7的溶液中,Fe3+、Cl-、Na+、NO3- | |
| B. | 水电离出的[H+]=1×10-3mol/L 的溶液中Na+、CO32-、Cl-、K+ | |
| C. | pH=1的溶液中NH4+、Cl-、Mg2+、SO42-、 | |
| D. | Al3+、HCO3-、I-、Ca2+ |
分析 A.铁离子只能存在于中性溶液中;
B.水电离出的[H+]=1×10-3mol/L 的溶液为酸性溶液或碱性溶液,碳酸根离子与氢离子反应;
C.pH=1的溶液为酸性溶液,四种离子之间不反应,都不与氢离子反应;
D.铝离子与碳酸氢根离子反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:A.pH=7的溶液为中性溶液,Fe3+只能存在于中性溶液中,故A错误;
B.水电离出的[H+]=1×10-3mol/L 的溶液为酸性或碱性溶液,CO32-与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.pH=1的溶液中存在大量氢离子,NH4+、Cl-、Mg2+、SO42-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.Al3+、HCO3-之间反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意熟练掌握离子不能共存的情况,如:发生复分解反应、发生氧化还原反应等,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 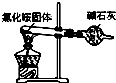 如图是氨气发生装置 | B. | 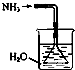 如图是氨气吸收装置 | ||
| C. | 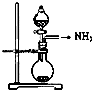 如图是氨气发生装置 | D. | 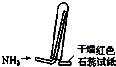 如图是氨气收集、检验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
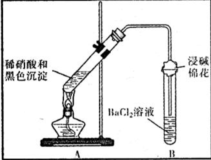 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
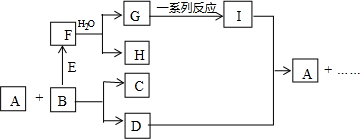
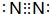 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
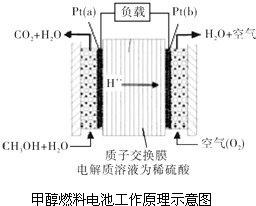 科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:
科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com