
分析 (1)a.用pH试纸测的pH只能到整数;
b.用玻璃棒蘸取溶液点在试纸中部,变色后再与标准比色卡对比;
c.氯水具有漂白性;
d.能使pH试纸显红色的溶液显酸性.
(2)蒸馏水润湿pH试纸,再用该试纸测定溶液的pH,则得到的结果是稀释以后的pH,氨水属于弱碱,存在电离平衡,加水稀释,电离平衡受到了促进.
解答 解:(1)a.用pH试纸测的pH只能到整数,不会到小数点后边一位,故错误;
b.用玻璃棒蘸取溶液点在试纸中部,变色后再与标准比色卡对比,不可以将pH试纸直接插入待测溶液.故错误;
c.氯水具有漂白性,用pH试纸测新制氯水的pH错误,故错误;
d.酸性溶液能使pH试纸显红色,故正确.
故选d;
(2)蒸馏水润湿pH试纸,再用该试纸测定溶液的pH,则得到的结果是稀释以后的pH,氨水属于弱碱,存在电离平衡,加水稀释,电离平衡受到了促进,所以用湿润的pH试纸分别测定c(OH-)相等的NaOH溶液和氨水的pH,误差较大的是NaOH溶液.
故答案为:NaOH溶液.
点评 本题考查学生pH表示溶液酸碱性的方法以及pH试纸的使用、弱电解质的电离等知识,属于基本知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
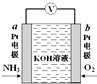 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 负极的电极反应式为:2NH3-6e-+6OH-═N2↑+6H2O | |
| C. | O2在电极b上发生还原反应 | |
| D. | 反应消耗的NH3与O2的物质的量之比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
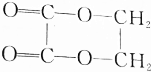 的化学方程式(无机试剂任选)并注明反应类型.
的化学方程式(无机试剂任选)并注明反应类型. (取代反应).
(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )| A. | 4.32 g | B. | 2.16 g | C. | 1.08 g | D. | 0.54 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
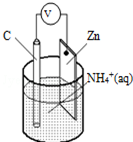
| A. | 碳为电池的负极 | B. | Zn极上发生氧化反应 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
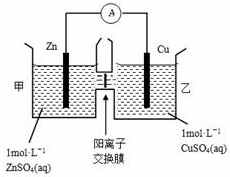
| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| C. | 电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) | |
| D. | 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com