
| A. | 烷烃的沸点随碳原子数增加而逐渐升高 | |
| B. | 任何烷烃分子中碳氢原子个数比都是相同的 | |
| C. | 丙烷与Cl2发生取代反应后生成的一氯代物不只是一种 | |
| D. | 正丁烷的熔点、沸点比异丁烷的高 |
分析 A.烷烃都是分子晶体,熔沸点取决于分子间作用力,分子间作用力随着分子量的增大而增大,分子量又随着碳原子数的增多而增大;
B.烷烃的通式是CnH(2n+2),不同烷烃中碳氢原子个数比不同;
C.丙烷有两种不同环境的氢原子,所以一氯代物有两种;
D.碳原子数相同的烃,支链越多熔沸点越低.
解答 解:A.烷烃熔沸点取决于分子间作用力.碳原子数越多,分子量越大,分子间作用力越强,熔沸点越高,故A正确;
B.烷烃的通式是CnH(2n+2),n不同,则2n+2不同,碳氢原子个数比不同,故B错误;
C.丙烷的一氯取代物有两种,故C正确;
D.正丁烷、异丁烷碳原子数相同,异丁烷有支链,正丁烷无支链,异丁烷沸点低,故D正确;
故选B..
点评 本题综合考查有机物的结构和性质,为高频考点,侧重于烷烃的结构和物理性质的考查,题目难度不大,注意烷烃沸点高低的规律.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32克O2所含的原子数目为2NA | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LCO2含有NA个分子 | |
| D. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) | |
| D. | 将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
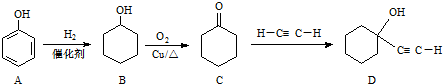
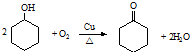 .
. ,反应类型依次是c(选填序号).
,反应类型依次是c(选填序号).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
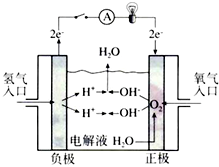 氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:
氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
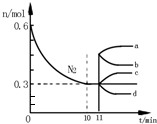 研究氮机器化合物对化工生产有重要意义.
研究氮机器化合物对化工生产有重要意义.| T/℃ | T1 | T2 | T3 |
| K | 10 | 2.5 | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | 摇头丸经消去、加成反应可制得冰毒 | |
| C. | 1mol大麻与溴水反应最多消耗4mol Br2 | |
| D. | 氯胺酮分子中环上所有碳原子可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com