
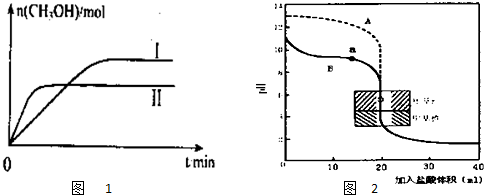
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |


科目:高中化学 来源: 题型:
| A | C | |
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
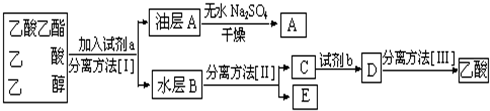
| 化合物 | 相对分子质量 | 密度/g?cm-3 | 水溶性 | 沸点/℃ |
| 甲酸 | 46 | 1.22 | 与水混溶 | 100.8 |
| 甲醇 | 32 | 0.79 | 与水混溶 | 64.7 |
| 甲酸甲酯 | 60 | 0.98 | 与水不互溶 | 32.0 |
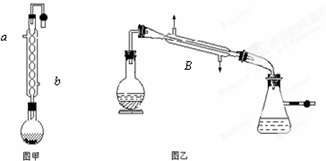
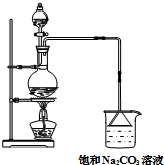 同学们认为课本中酯化反应的装置有很多缺点,进行了部分改进,如图所示,进行制备甲酸甲酯的实验,回答下列问题:
同学们认为课本中酯化反应的装置有很多缺点,进行了部分改进,如图所示,进行制备甲酸甲酯的实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、至少存在5种离子 |
| B、Cl-一定存在,且c(Cl-)≥0.1mol/L |
| C、SO42-、NH4+一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2、Al2(SO4)3、MgCl2、K2CO3 |
| B、BaCl2、Na2SO4、CaCO3、KOH |
| C、AgNO3、NaCl、KCl、CuCl2 |
| D、Fe2(SO4)3、K2CO3、KHSO4、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
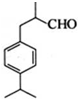 是一种重要的香料.用有机物I为原料可以合成兔耳草醛,其合成路线如图所示:
是一种重要的香料.用有机物I为原料可以合成兔耳草醛,其合成路线如图所示: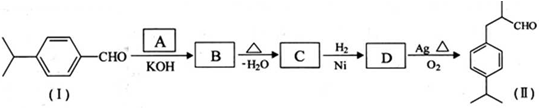
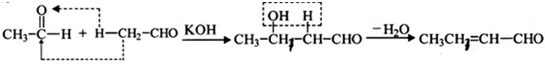
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com