
 X.Y.Z.W均为短周期元素,它们在元素周期表中的位置如图所示.X.Y.Z的最外层电子数之和为14,下列说法中正确的是( )
X.Y.Z.W均为短周期元素,它们在元素周期表中的位置如图所示.X.Y.Z的最外层电子数之和为14,下列说法中正确的是( )| A、原子半径:W>Z>Y>X |
| B、W的单质能与水反应,生成一种具有漂白性的物质 |
| C、四种元素的氢化物中,Z的氢化物最稳定 |
| D、最高价氧化物对应水化物的酸性:W>Z>X |


科目:高中化学 来源: 题型:
| A、100 mL 2 mol?L-1的盐酸溶液 |
| B、25 mL 0.8 mol?L-1的稀HNO3溶液 |
| C、100 mL 1 mol?L-1的稀H2SO4溶液 |
| D、250 mL 0.4 mol?L-1的稀盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图甲可以判断出反应A(g)+B(g)?2C(g)的△H<0,T2>T1 |
| B、图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量的CuO,调节pH≈4 |
| D、图丁表示25℃时,用0.1 mol/L 盐酸滴定20 ml 0.1mol/LNaOH溶液,溶液的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在AsCl3分子中,砷原子最外层电子数为8 |
| B、Na3AsO4溶液的pH等于7 |
| C、砷的氢化物的化学式为AsH3,其还原性比NH3的弱 |
| D、第一电离能:As<Se |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |

| 19.98+20.00+20.80+20.02 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

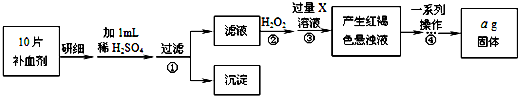
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL、1 mol/L NaCl溶液 |
| B、25 mL、3 mol/L NH4Cl 溶液 |
| C、75 mL、2 mol/L MgCl2溶液 |
| D、75 mL、2 mol/L FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com