
 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.分析 I.(1)将等体积、等物质的量浓度的盐酸与氢氧化钠溶液混合后,生成NaCl溶液,溶液显中性;
(2)醋酸为弱电解质,溶液中部分电离出氢离子,等体积的两溶液混合pH=7,溶液显示中性,若二者恰好反应生成醋酸钠溶液显碱性;
(3)醋酸溶液中醋酸的浓度大于氢离子浓度,氢氧化钠溶液中氢氧化钠的浓度等于氢氧根离子的浓度,等体积混合后,醋酸过量;
(4)CH3COOH和NH3•H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性;
II.(1)根据滴定终点,锥形瓶中的溶液从红色变为无色时,且半分钟内不褪色,应停止滴定;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)锥形瓶用蒸馏水洗净即可,不能用待测溶液润洗,否则,待测溶液偏多,导致结果偏高;
(4)读数时目光平视,凹液面最低点与刻度线相切.
解答 解:I.(1)将等体积、等物质的量浓度的盐酸与氢氧化钠溶液混合后,生成NaCl溶液,溶液显中性,溶液中离子浓度大小关系为:c(Cl?)=c(Na+)>c(H+)=c(OH?);
故答案为:c(Cl?)=c(Na+)>c(H+)=c(OH?);
(2)醋酸为弱电解质,溶液中部分电离出氢离子,等体积的两溶液混合pH=7,溶液显示中性,若二者恰好反应生成醋酸钠溶液显碱性,若溶液显中性,则醋酸稍过量,即m大于n;
故答案为:大于;
(3)醋酸溶液中醋酸的浓度大于氢离子浓度,氢氧化钠溶液中氢氧化钠的浓度等于氢氧根离子的浓度,PH值为3的CH3COOH 溶液与PH值为11的NaOH 溶液等体积混合后,醋酸过量,溶液显酸性;
故答案为:酸性;
(4)当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),由于NH4+会发生水解,所以c(NH4+) 小于0.05mol/L;
故答案为:小于;等于;
II.(1)因滴定终点时,锥形瓶中的溶液从红色变为无色时,且半分钟内不褪色,停止滴定,
故答案为:红色变为无色;
(2)滴定时眼睛应观察锥形瓶内溶液颜色的变化,以判定终点的到达,
故答案为:锥形瓶内溶液颜色的变化;
(3)锥形瓶用蒸馏水洗净即可,不能用待测溶液润洗,否则,待测溶液偏多,所以消耗标准液的体积偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$可知,c(待测)偏高;
故答案为:偏高;
(4)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60,
故答案为:22.60.
点评 本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系、酸碱中和滴定的操作、误差分析,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确溶液中电荷守恒、物料守恒、盐的水解比较溶液中离子浓度大小的方法、掌握中和滴定的原理是解题的关键.


科目:高中化学 来源: 题型:填空题
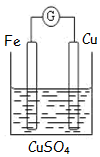 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 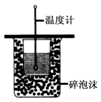 进行中和热的测定 | |
| B. | 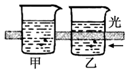 运用该实验可区分胶体和溶液 | |
| C. | 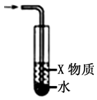 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. | 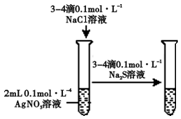 验证AgCl溶解度大于Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:
欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾石墨是一类共价化合物 | B. | 钾石墨导电性比石墨强 | ||
| C. | 钾石墨遇水不产生氢气 | D. | C8K、C24K和C36K属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向酸性KMnO4溶液中滴加H2O2溶液至过量 | 紫色消失 | H2O2在该反应中作还原剂 |
| B | 溶有SO2的BaCl2溶液中通入气体X | 有白色沉淀生成 | X一定是Cl2 |
| C | 向FeBr2和KSCN混合溶液中滴入少量新制氯水,再加入CCl4混合振荡、静置 | 有机相呈红棕色,水相呈无色 | Fe2+的还原性大于Br- |
| D | 铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中 | 铝丝表面变红色 | 铝可从铜盐溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com