
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml0.1mol/L HCl溶液混合后溶液呈酸性,所得溶中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,恰好反应生成碳酸钠溶液,碳酸钠溶液中碳酸根离子分步水解溶液显碱性;
B.20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后反应:CH3COONa+HCl=NaCl+CH3COOH,反应后得到溶液中含有CH3COOH,CH3COONa,NaCl,溶液呈酸性,说明氢氧根离子浓度大于氢根离子浓度;
C.pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性,c(H+)<c(OH-),c(Cl-)<c(NH4+ );
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合恰好反应生成醋酸钠,溶液中存在质子守恒.
解答 解:A.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,恰好反应生成碳酸钠溶液,碳酸钠溶液中碳酸根离子分步水解溶液显碱性,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3- ),故A错误;
B.20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后反应:CH3COONa+HCl=NaCl+CH3COOH,反应后得到溶液中含有CH3COOH,CH3COONa,NaCl,溶液的酸性是醋酸电离导致的,而醋酸的电离很有限(0.1mol/L的醋酸,大于5%电离),因而C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B正确;
C.pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,一水合氨又电离出氢氧根离子,氨水过量,溶液呈碱性,c(H+)<c(OH-),c(Cl-)<c(NH4+ ),c(Cl-)+c(H+)<c(NH4+ )+c(OH-),故C错误;
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合恰好反应生成醋酸钠,溶液中存在质子守恒c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选B.
点评 本题考查了电解质溶液中离子浓度大小比较、酸碱反应后溶液酸碱性的判断、弱电解质电离平衡的影响因素等知识点,掌握基础是解题关键.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 工业废水可经过“再生”处理,用于城市道路保洁、喷泉和浇花用水 | |
| C. | 硅单质常作为制备光导纤维的主要材料 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl只存在一种空间结构 | |
| B. | CH2Cl2只存在一种空间结构 | |
| C. | CHCl3只存在一种空间结构 | |
| D. | CH4的四个价键的键角和键长都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
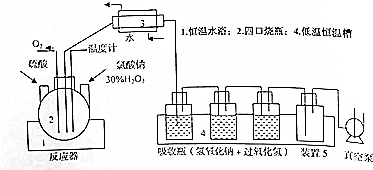
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| D. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
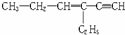 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,6 | B. | 4,3,8 | C. | 2,5,4 | D. | 4,4,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该物质所含有的微粒间作用力的类型为离子键、共价键.
,该物质所含有的微粒间作用力的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
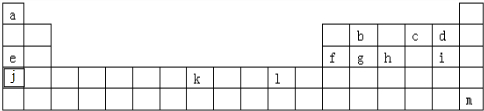
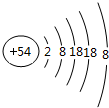
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com