
 TiCl4+2CO(2分)、TiCl4+2Mg
TiCl4+2CO(2分)、TiCl4+2Mg Ti+2MgCl2(2分)
Ti+2MgCl2(2分) TiCl4+2CO。镁在高温下和四氯化钛发生置换反应,方程式为TiCl4+2Mg
TiCl4+2CO。镁在高温下和四氯化钛发生置换反应,方程式为TiCl4+2Mg Ti+2MgCl2。
Ti+2MgCl2。

科目:高中化学 来源:不详 题型:单选题
| A.制普通玻璃的主要原料是纯碱、石灰石、石英砂 |
| B.工业上电解熔融的氯化钠来制取钠 |
| C.将二氧化硫催化成三氧化硫后,在吸收塔内用水吸收制得浓硫酸 |
| D.制造普通水泥的主要原料是黏土、石灰石 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
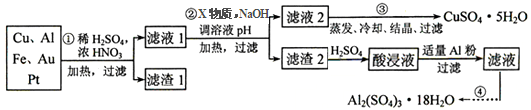
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
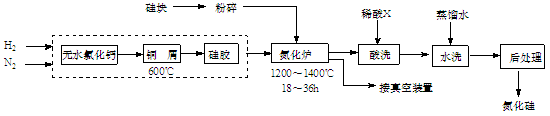
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.①②⑤⑦ | C.①⑧⑨ | D.①②⑥⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
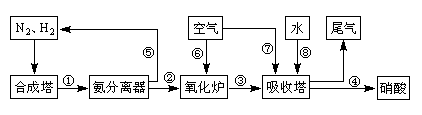
 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
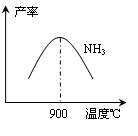
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁元素 | B.铁单质 | C.四氧化三铁 | D.硫酸铁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
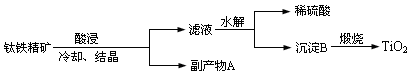
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com