
| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为吸热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中仍充入1molA和1molB,反应达到平衡状态时,C的物质的量分数小于60% |
分析 A.恒温恒压下,容器的体积减小,不能用浓度变化量表示平均反应速率;
B.增大压强平衡向正反应方向移动,与原平衡相比C的物质的量分数增大,而再升高温度,C的物质的量分数减小为60%,说明升高温度平衡逆反应方向移动;
C.保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,等效为开始加入2molA、2molB,压强增大平衡正向移动,平衡时C的物质的量分数大于60%,计算开始时C的物质的量分数,与60%相比判断反应进行方向;
D.t℃时,在2L密闭、恒压容器中充入1molA和1molB,随反应进行容器内压强减小,等效为在原平衡基础上降低压强,平衡逆向移动.
解答 解:A.恒温恒压下,容器的体积减小,不能用浓度变化量表示平均反应速率,故A错误;
B.增大压强平衡向正反应方向移动,与原平衡相比C的物质的量分数增大,而再升高温度,C的物质的量分数又增大为60%,说明升高温度平衡逆反应方向移动,而升高温度平衡向吸热反应方向移动,故正反应为放热反应,故B错误;
C.保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,等效为开始加入2molA、2molB,压强增大平衡正向移动,平衡时C的物质的量分数大于60%,开始时C的物质的量分数为$\frac{1.5mol}{0.5mol+0.5mol+1.5mol}$=60%,故平衡向正反应方向移动,故C错误;
D.t℃时,在2L密闭、恒压容器中充入1molA和1molB,随反应进行容器内压强减小,等效为在原平衡基础上降低压强,平衡逆向移动,反应达到平衡状态时,C的物质的量分数小于60%,故D正确,
故选:D.
点评 本题考查化学平衡有关计算,A选项为易错点,注意体积发生变化,C选项可以利用平衡常数与浓度商相对大小进行判断但比较繁琐,注意利用等效思想解答,属于易错题目,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | M溶液的pH>7 | |
| B. | 25℃时,溶度积常数Ka[NH3•H2O]约为1X10-7 | |
| C. | 25℃时,向M溶液中加少量盐酸,$\frac{c(N{H}_{4}^{+})}{(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$的比值变小 | |
| D. | 25℃时,向1L0.2mol•L-1NH3•H2O溶液中加入1L0.2mol•L-1MgCl溶液,有Mg(OH)2沉淀产生(混合后溶液的体积变化不计) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2+2NaOH═NaNO3+NaNO2+H2O | |
| B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2 | |
| C. | CaH2+2H2O═Ca(OH)2+2H2↑ | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

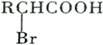
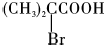 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应;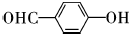 ;
;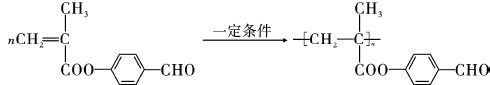 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
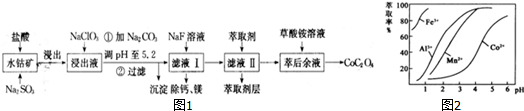
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A的转化率变小 | B. | 平衡向逆反应方向移动 | ||
| C. | D的体积分数变大 | D. | a+b>c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
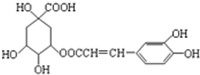 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )| A. | 分子式为C16H13O9 | |
| B. | 与浓溴水既能发生取代反应又能发生加成反应 | |
| C. | 1 mol咖啡鞣酸水解时可消耗8 mol NaOH | |
| D. | 能使酸性KMnO4溶液褪色,说明分子结构中有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
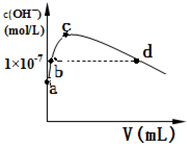 CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空:
CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空: .
. ;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大.
;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com