
常温下,在密闭容器中将物质的量相同的下列各组气体混合,完全反应后容器中压强没有发生变化的是 ( )
A.H2S和SO2 B.NO和O2 C.HI和Cl2 D.H2S和Cl2
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
下列关于化石燃料的加工说法正确的是( )
A.石油裂化主要得到乙烯
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列关于玻璃的叙述正确的是( )
下列关于玻璃的叙述正确的是( )



















 A.制普通玻璃的主要是纯碱、石灰石、石英
A.制普通玻璃的主要是纯碱、石灰石、石英
 B.普通玻璃的成分主要是硅酸钠和二氧化硅
B.普通玻璃的成分主要是硅酸钠和二氧化硅
 C.玻璃是几种成分熔化在一起的晶体
C.玻璃是几种成分熔化在一起的晶体
 D.玻璃是硅酸钠盐,有一定的熔点
D.玻璃是硅酸钠盐,有一定的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是_________________________________________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O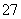 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________和________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 ℃,沸点:180.8 ℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为
2CH3COOC2H5C2H5ONa,CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体回流①,钠熔化振荡②,小米状钠珠回收有机液体③,加入乙酸乙酯④,橘红色溶液乙酸酸化⑤,含乙酰乙酸乙酯的混合物⑥,⑦,乙酰乙酸乙酯粗产品
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度/(g·cm-3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点/℃ | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点/℃ | 881.4 | 80 | 111 | 138.4 | 76.8 |
最好选用________来熔化钠。是否能用四氯化碳?________(填“是”或“否”),理由是________________________________________________________________________。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是_______________________________,
烧瓶配上长导管的作用是______________________________________________,
导管上端接一干燥管的目的是______________________________________________。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是
________________________________________________________________________,
写出步骤⑦实验操作的主要仪器____________(填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。
粗产品无水硫酸钠,过滤,水浴蒸馏,减压蒸馏,乙酰乙酸乙酯
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是________________________________________________________________________。
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。
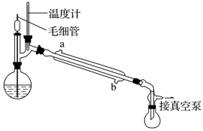
冷凝管的进出水方向应________口进,________口出(填“a”或“b”)。毛细管的作用是________________________________________________________________________。
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氢硫酸、亚硫酸、硫酸的说法中正确的是 ( )
A它们都有酸性,电离出的H+有弱氧化性
B它们都是酸,彼此之间不发生反应
C亚硫酸易分解放出SO2,所以它是挥发性酸
D在空气中放置,它们都会因氧化而变质
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硅能与碱反应产生氢气,将镁、铝、硅的混和物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份跟足量的盐酸反应,最终产生的H2一样多.则镁与硅物质的量之比为 ( )
A.2∶1 B.4∶1 C.1∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块
A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中,△H能正确表示物质的燃烧热的是 ( )
A.CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B C(s) +1/2O2(g) ==CO(g); △H=-110.5 kJ/mol
C. H2(g) +1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com