
���ڻ�ѧ��Ӧ:2Na+2H2O 2NaOH+H2�����й������������
2NaOH+H2����������������
A���÷�Ӧ�м��оɻ�ѧ���Ķ���,Ҳ���»�ѧ�����γɡ�
B���÷�Ӧ��ÿ����1 mol Na,��ͬʱ����18 g H2O,����1 mol NaOH��11��2 L H2(��״����)��
C�����ڸ÷�Ӧ���������Զ�����,�ʸ÷�Ӧһ���Ƿ��ȷ�Ӧ��
D�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ,���Զ��Ѿɻ�ѧ�������յ�����һ�����γ��»�ѧ�����ų��������١�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ��ݸ����У��һ��ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
������������ȷ����
A�������NaCl���岻�ܵ��磬��NaCl�ǵ����
B��ʳ��ˮ�ܵ��磬����ʳ��ˮ�ǵ����
C��������������ˮ�ܵ��磬�������������ǵ����
D��һ������������ǵ���ʣ���ô��һ���Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡУ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������Ӽ���ķ�����ȷ����
A��ij��Һ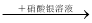 ������ɫ������˵��ԭ��Һ����Cl��
������ɫ������˵��ԭ��Һ����Cl��
B��ij��Һ ������ɫ������˵��ԭ��Һ����SO42��
������ɫ������˵��ԭ��Һ����SO42��
C��ij��Һ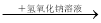 ������ɫ������˵��ԭ��Һ����Cu2+
������ɫ������˵��ԭ��Һ����Cu2+
D��ij��Һ ������ɫ���壬˵��ԭ��Һ����CO32��
������ɫ���壬˵��ԭ��Һ����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�����и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��HCl��Һ����OH��
B��NaOH��Һ����H��
C��NaCl��Һ�м���OH��Ҳ��H��
D�������£��κ����ʵ�ˮ��Һ�ж���H����OH������KW��1��10��14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�����и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ڿ��淴Ӧ��2SO2(g)��O2(g) 2SO3(g)�����д�ʩ��ʹ��Ӧ���л���Ӱٷ�������ѧ��Ӧ���ʺͻ�ѧƽ�ⳣ�����仯����
2SO3(g)�����д�ʩ��ʹ��Ӧ���л���Ӱٷ�������ѧ��Ӧ���ʺͻ�ѧƽ�ⳣ�����仯����
A������ѹǿ B�������¶� C��ʹ�ô��� D�������O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
��6�֣��±�����һЩ��ѧ�����ܵ�����
��ѧ�� | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
����(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
�����������ݻش�1������3����
��1���������ʱ������е�������͵���
A.H2 B.Cl2 C.Br2 D.I2
��2��X2 + H2 = 2HX��X����±��ԭ�ӣ��ķ�Ӧ�� ��Ӧ������ȡ����ȡ���
��3����ͬ�����£������ʵ�����X2��±�ص��ʣ��ֱ���������������Ӧ���ų������յ����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������Ϣ�ش�17��19��
��Դ�ɻ���Ϊһ����Դ�Ͷ�����Դ����Ȼ�������ֳ���ʽ�ṩ����Դ��Ϊһ����Դ��������������Դ�����������ȡ����Դ��Ϊ������Դ��������һ�ָ�Ч��û����Ⱦ�Ķ�����Դ������������Ȼ���д������ڵ�ˮ����ȡ��2H2O ( g ) �� 2H2 ( g ) + O2 ( g ) ��H = +517.6 kJ/mol
����������ȷ����
A�������Ƕ�����Դ B��ˮ���Ƕ�����Դ
C����Ȼ���Ƕ�����Դ D����¯����һ����Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�������
��8�֣������£���20.0 g 14%��NaCl��Һ��30.0 g 24%��NaCl��Һ��ϣ��õ��ܶ�Ϊ1.17 g/cm3�Ļ����Һ�����㣺
��1���û����Һ��NaCl��������������3�֣�
��2���û����Һ��NaCl�����ʵ���Ũ�ȡ���3�֣�
��3����1000 gˮ�������________Ħ���Ȼ��ƣ�����ʹ��Ũ��ǡ�������������ҺŨ����ȡ�(����1λС��)��2�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡУ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����Ҫ���ȷ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
B�����ȷ�Ӧ�ڳ�����һ����������
C����Ӧ�Ƿ��Ȼ������ȣ����뿴��Ӧ��������������е�����������Դ�С
D����ѧ��Ӧֻ���������ʣ�û�������ı仯
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com