
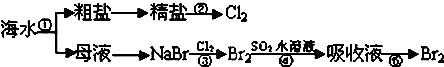
| A、实验室进行①的操作需用到坩埚、玻璃棒、酒精灯 |
| B、②是一个将电能转化为化学能的过程 |
| C、③④⑤涉及的反应均为氧化还原反应 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有大量晶体析出时停止加热 |


科目:高中化学 来源: 题型:
| A、5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g |
| B、溶解5.1 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
| C、生成白色沉淀的最大质量为13.6 g |
| D、若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏属物理变化,煤的干馏和石油裂化、裂解均属于化学变化 |
| B、豆科作物根瘤菌将含氮化合物转化为蛋白质是氮的固定 |
| C、乙醛、葡萄糖与新制的Cu(OH)2悬浊液共热,都产生红色沉淀 |
| D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲、乙、丙属同系物,均可与氯气发生取代反应 |
| B、甲的分子中所有碳原子在同一直线上 |
| C、甲、乙、丙中,丙的沸点最低 |
| D、丙有3种不同沸点的二氯取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食用加碘盐可预防碘缺乏症,加碘盐中加的含碘物质是碘单质 |
| B、因为NaCl的水溶液能导电,所以NaCl溶液属于强电解质 |
| C、电解熔融NaCl得到23.0g金属钠时能产生22.4 L氯气(标准状况下) |
| D、37Cl 是氯元素的一种同位素,23Na37Cl中质子数和中子数之比是7:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是 0.225 mol?L-1?s-1 |
| B、该温度下,压缩气体体积至1L,反应的平衡常数增大 |
| C、恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 |
| D、在上述反应体系中加入催化剂,化学反应速率增大,则E1和E2均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 关于下列各图的叙述不正确的是( )
关于下列各图的叙述不正确的是( )| 表 丙 | |
| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2=2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.045mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表丙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com