
【题目】下列物质的使用不涉及化学变化的是( )
A.明矾用作净水剂B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃D.小苏打粉作食品膨松剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中有错误的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线上
C.用酒精萃取碘水溶液中的碘
D.称量时,称量物放在称量纸上或烧杯中,置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A.MgCl2 + Ba(OH)2 == BaCl2 + Mg(OH)2↓B.CO2 + 2NaOH == Na2CO3 + H2O
C.CaCO3 ![]() CaO + CO2↑D.H2 + CuO ==H2O + Cu
CaO + CO2↑D.H2 + CuO ==H2O + Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有单质A、B、C及化合物D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
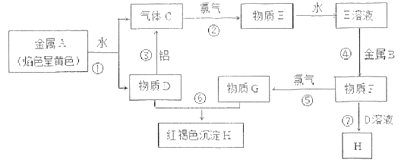
请根据以上信息回答下列问题:
(1)反应③是D物质的水溶液与金属铝反应,金属铝被氧化___(写化学式);
(2)步骤⑦中刚生成的白色沉淀颜色会迅速发生变化,最终生成红褐色沉淀H,请写出由白色沉淀变成H的化学方程式:___;
(3)检验G中所含的金属离子时,在G溶液中加入硫氰化钾溶液,离子方程式为:___;
(4)工业上将氯气通入D溶液中制取消毒液,反应的化学方程式为___,1mol氯气发生反应,转移电子___mol;消毒液中的有效成分是___(填名称);
(5)将0.1molA的碳酸盐溶液和0.15molE溶液混合,有如下两种方式:
A.将含A的碳酸盐溶液逐滴加入到E溶液中;
B.将E溶液逐滴加入到含A的碳酸盐溶液中;
理论上产生气体比较多的是___(填序号),多___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。
(1)氨气属于共价型氢化物,工业常用氨气和醋酸二氨合铜[Cu(NH3)2]Ac的混合液来吸收CO(醋酸根离子简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3CO]Ac
①氨水溶液中各元素原子的第一电离能从大到小排列顺序为___________。
②醋酸分子(CH3COOH)中的两个碳原子的杂化方式分别是_________________。
③生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________(填序号)。
A.离子键b.金属键c.共价键d.配位键
(2)某离子化合物XY2,晶胞结构如图所示,其中6个Y原子用数字1~6标注。
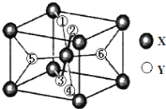
已知1、2、3、4号Y原子在晶胞上、下面上,则5、6号Y原子均在晶胞_________(填“侧面”或“内部”)。
②根据以上信息可以推知,XY2晶体的熔沸点______(填“>”、“=”或“<”)固态氨的熔沸点。
③若该晶胞的边长为anm,密度为ρg/cm3,XY2的摩尔质量为Mg/mol,则阿伏加德罗常数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烷(C8H18)是汽油的重要成分,其与O2反应的能量变化如图所示。下列判断正确的是
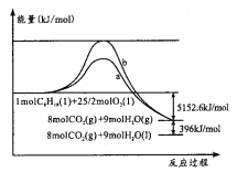
A. 曲线b代表加入催化剂时的能量变化
B. 反应物的总能量小于生成物的总能量
C. 表示辛烷燃烧热的热化学方程式:C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-5152.6kJ/mol
D. 反应a、b的活化能不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。
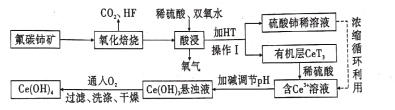
回答下列问题:
(l)CeFCO3中Ce的化合价为____ 。
(2)氧化培烧时不能使用陶瓷容器,原因是________.。
(3)氧化焙烧后的产物之一为CeO2.则酸浸时发生反应的离子方程式为____。
(4)HT是一种难溶于水的有机溶剂,则操作I的名称为 _____。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是____。
(6)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+的水溶液,从平衡角度解释其原因________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+的水溶液,从平衡角度解释其原因________。
(7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
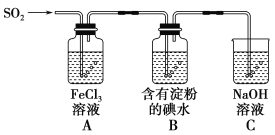
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com