
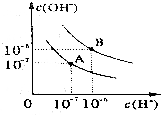
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:分析 (1)横轴是氢离子浓度,纵轴是氢氧根离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算出A曲线的Kw,然后结合水的电离过程吸热判断25℃时水的电离平衡曲线;
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pHa与强碱的pHb之间应满足的关系;
(4)pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应,根据盐的性质分析.
解答 解:(1)曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)•c(OH-)=10-12;水的电离时吸热过程,加热促进电离,所以A曲线代表25℃时水的电离平衡曲线,
故答案为:A;水的电离是吸热过程,温度低时,水的电离程度小,c(H+)、c(OH-)小;
(2)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)•10-5 mol•L-1=V(H2SO4)•10-4 mol•L-1,得V(NaOH):V(H2SO4)=10:1,
故答案为:10:1;
(3)90°C时,水的离子积为10-12,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以10-amol/L×10=10b-12 mol/L×1,所以a+b=12+1=13,
故答案为:pHa+pHb=13;
(4)曲线B对应温度下,pH=2的盐酸溶液和pH=10的某BOH溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果碱是强碱,则盐溶液呈中性,实际上溶液呈碱性,则碱为弱碱,生成强酸弱碱盐水解呈碱性,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性,
故答案为:BOH为弱碱,c(BOH)?c(HCl),等体积混合两溶液时,BOH过量,反应后溶液呈碱性.
点评 本题考查水的电离和酸、碱混合的pH计算问题,题目难度中等,注意温度不同而使水的离子积常数不同是解本题的关键,侧重于考查学生的分析能力和计算能力.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 向30mL0.1mol•L-1NaOH溶液滴加20mL0.1mol•L-1H2C2O4溶液后:3c(Na+)=2[c(HC2O${\;}_{4}^{-}$)+c(C2O${\;}_{4}^{2-}$)+c(H2C2O4)] | |
| B. | 将同浓度的CH3COONa溶液和HCl溶液按照体积比2:1混合,混合后溶液呈酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 向NH4HSO4溶液中加入NaOH至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)═c(NH${\;}_{4}^{+}$) | |
| D. | 常温下将pH为3的CH3COOH溶液与pH为11的NaOH溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1某一元弱酸(HA)溶液中:c2(H+)=c(H+)•c(A-)+Kw | |
| B. | 已知Ka(HNO2)=4.6×10-4,Kb(NH3•H2O)=1.8×10-5,可推断NH4NO3溶液呈碱性 | |
| C. | 25℃时,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大后减小 | |
| D. | NH4Cl溶液中滴加NaOH溶液至溶液呈中性时,则有c(Na+)>c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
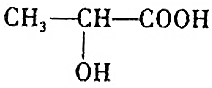 的反应(官能团羟基、羧基,具有醇和酸的性质)
的反应(官能团羟基、羧基,具有醇和酸的性质)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
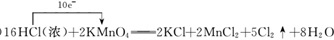 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com