
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Ca(OH)2溶液中通入过量SO2气体 |


科目:高中化学 来源: 题型:
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A、OA段所发生反应的离子方程式:H++OH-═H2O、CO32-+H+═HCO3- |
| B、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 |
| C、原NaOH溶液的物质的量浓度为0.5 mol?L-1 |
| D、标准状况下产生CO2气体的体积为56mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
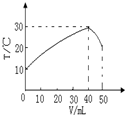 向盛有50mL1.00mol?L-1HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )
向盛有50mL1.00mol?L-1HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )| A、该实验表明化学能可以转化为热能 |
| B、NaOH溶液的浓度大于1.00mol?L-1 |
| C、V=50mL时,混合液的pH>7 |
| D、该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是平否漏气 |
| C、明矾和漂白粉常用于自来水的净化和杀菌流消毒,两者原理相同 |
| D、化学变化中一定有能量变化,而有能量变化过程不一定发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②④⑤⑥⑦ |
| C、②③④⑥⑦⑧ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、向CaCl2溶液中通入CO2至过量 |
| B、向澄清石灰水中通入CO2至过量 |
| C、向Na2SiO3溶液中通入CO2至过量 |
| D、AlCl3溶液滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com