
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 | |
| B. | 上述实验中,共有两个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②证明Fe2+有还原性,保存FeCl2溶液时,要向溶液中加入少量铁粉 |
分析 ①向KMnO4晶体滴加浓盐酸,产生黄绿色气体,该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,高锰酸钾是氧化剂、浓盐酸是还原剂;
②向FeCl2溶液中通入少量氯气,溶液变黄色,铁元素化合价由+2价变为+3价、Cl元素化合价由0价变为-1价,氯化亚铁是还原剂、氯气是氧化剂;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色,铁离子和碘离子发生氧化还原反应生成碘和亚铁离子,I元素化合价由-1价变为0价、铁元素化合价由+3价变为+2价,所以碘离子作还原剂、铁离子为氧化剂,以此解答.
解答 解:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体,该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,高锰酸钾是氧化剂、浓盐酸是还原剂,氧化性:MnO4->Cl2;
②向FeCl2溶液中通入少量氯气,溶液变黄色,铁元素化合价由+2价变为+3价、Cl元素化合价由0价变为-1价,氯化亚铁是还原剂、氯气是氧化剂,氧化性:Cl2>Fe3+;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色,铁离子和碘离子发生氧化还原反应生成碘和亚铁离子,I元素化合价由-1价变为0价、铁元素化合价由+3价变为+2价,所以碘离子作还原剂、铁离子为氧化剂,氧化性:Fe3+>I2.
A.通过以上分析知,上述实验证明氧化性:MnO4->Cl2>Fe3+>I2,故A正确;
B.3个反应都为氧化还原反应,故B错误;
C.氧化性:MnO4->Cl2>Fe3+>I2,Fe3+能使淀粉KI试纸变蓝,则氯气也能使淀粉KI试纸变蓝,故C错误;
D.实验②证明Fe2+有还原性,可被氯气氧化,保存FeCl2溶液时,要向溶液中加入少量铁粉,可与Fe3+反应生成Fe2+,防止被氧化,故D正确.
故选AD.
点评 本题考查氧化还原反应以及氯气的化学性质,题目难度不大,在学习中要注意比较氧化性、还原性的方法,氧化还原反应电子守恒的利用等问题.


科目:高中化学 来源: 题型:多选题
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜粉溶于氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| C. | 氯气与冷氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向氯化铝溶液中加入过量氨水:4OH-+Al3+═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁能被磁铁吸引,且纯铁比生铁更易生锈 | |
| B. | 向煤中加入适量石灰石,可大大减少燃烧产物中SO2的量 | |
| C. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 维生素C能帮助人体将食物中摄取的Fe3+转化为Fe2+,因为维生素具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是一门以实验为基础的自然科学 | |
| B. | 化学为解决环境、能源和资源等问题提供更多的有效途径 | |
| C. | 化学不支持高新技术的快速发展 | |
| D. | 学好化学的关键是掌握实验方法以及完成化学实验所必需的技能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
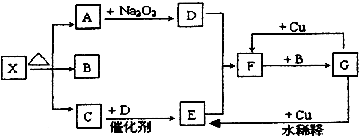
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
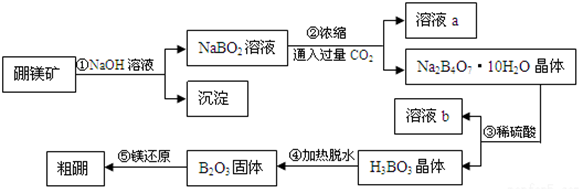
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com