
| 步骤和现象 | 现象 |
| Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y | |
| Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 | 出现浑浊 |
| Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀变为黑色 |
| Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀逐渐溶解 |
 Ag+(aq)+Cl-(aq).
Ag+(aq)+Cl-(aq). Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.分析 (1)将等体积等浓度的AgNO3溶液和NaCl溶液混合,反应生成AgCl白色沉淀,存在的沉淀溶解平衡为AgCl(g)  Ag+(aq)+Cl-(aq);
Ag+(aq)+Cl-(aq);
(2)由步骤Ⅱ的浑浊Ag2S可知,滤液X中除了含有Na+、NO3-,还含有Ag+、Cl-离子;
(3)该温度下,Ag2S比AgCl溶解度更小,故氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq);
(4)在白色沉淀AgCl中,存在平衡:AgCl(g)  Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
(5)A、在步骤Ⅳ之后,继续滴加浓硝酸后,硝酸与氨水中和,生成Ag+,平衡左移,又有AgCl沉淀生成,故A正确;
B、由步骤Ⅳ可以推测:氨水可以结合Ag+,不能与Ag反应,实验室可不用氨水洗涤银镜反应后的试管,故B错误;
C、若在白色沉淀AgCl中滴加NaOH溶液,不发生反应.
解答 解:(1)将等体积等浓度的AgNO3溶液和NaCl溶液混合,反应生成AgCl白色沉淀,存在的沉淀溶解平衡为AgCl(g)  Ag+(aq)+Cl-(aq);
Ag+(aq)+Cl-(aq);
故答案为:AgCl(g)  Ag+(aq)+Cl-(aq);
Ag+(aq)+Cl-(aq);
(2)由步骤Ⅱ的浑浊Ag2S可知,滤液X中除了含有Na+、NO3-,还含有Ag+、Cl-离子;
故答案为:Ag+、Cl-;
(3)该温度下,Ag2S比AgCl溶解度更小,故氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq);
故答案为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq);该温度下,Ag2S比AgCl溶解度更小;
(4)在白色沉淀AgCl中,存在平衡:AgCl(g)  Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
故答案为:AgCl(g)  Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解;
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解;
(5)A、在步骤Ⅳ之后,继续滴加浓硝酸后,硝酸与氨水中和,生成Ag+,平衡左移,又有AgCl沉淀生成,故A正确;
B、由步骤Ⅳ可以推测:氨水可以结合Ag+,不能与Ag反应,实验室可不用氨水洗涤银镜反应后的试管,故B错误;
C、若在白色沉淀AgCl中滴加NaOH溶液,不发生反应,沉淀不能溶解,故C错误;
故答案为:BC.
点评 本题考查了性质实验方案的设计,题目难度较大,涉及难溶物溶度积的计算、氧化还原反应的配平、性质实验方案评价等知识,根据实验现象得出正确结论为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )| A. | NH3分子内可以形成氢键,故NH3很容易液化 | |
| B. | a电极的电极反应式为:NH3-5e-+5OH-═NO+4H2O | |
| C. | 正极消耗标准状况下空气2.24L时,电池中转移的电子数目为0.4NA | |
| D. | 反应过程中,K+向b极移动.一段时间后,电解质溶液的pH将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSP(AB2)小于KSP(CD),则AB2的溶解度一定小于CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的KSP增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
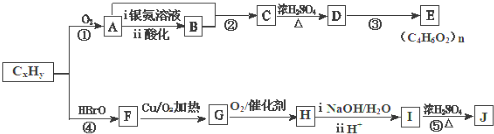

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com