
 CO(g)+H2(g)
CO(g)+H2(g) 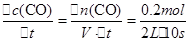 ="0.01" mol/(L?S),增加固态碳的量,不改变反应速率,故则正反应的速率不变。
="0.01" mol/(L?S),增加固态碳的量,不改变反应速率,故则正反应的速率不变。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
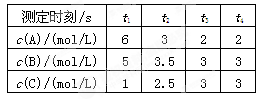
 2C
2C查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示: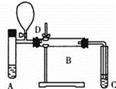

| | 沸点 | 水溶性 |
| 甲醇 | 65℃ | 与水相溶 |
| 甲醛 | -21℃ | 与水相溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+3H2(g) ΔH>0测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) ΔH>0测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
| A.10 min时,改变的外界条件可能是温度 |
| B.0~5 min内,V(H2)=0.1 mol·L-·min— |
| C.恒温下,缩小容器体积,平衡后c(H2)肯定减小 |
| D.10—12 min时反应的平衡常数逐渐增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
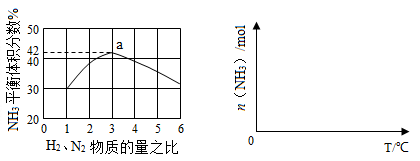
 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1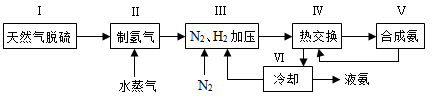
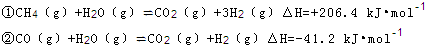
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com