
C、O、Si、Cl、Na、Fe是中学化学中常见的六种元素.
(1)Si位于元素周期表第三周期第ⅣA族,Fe2+的离子结构示意图 ,Cl的基态原子外围电子层排布式为 ;
(2)用“>”或“<”填空:
第一电离能 键能 沸点
O Na H﹣Cl H﹣Si CO2 H2O
(3)氯的一种常见含氧酸有漂白性,它与H2CO3酸性强弱不同,写出可以证明此结论一个化学方程式 ;
(4)黄绿色气体二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.工业上常利用氯酸钠和浓盐酸来制备ClO2,同时还得到一种黄绿色的气体单质、一种无色液体和一种常见离子化合物.写出该反应的化学方程式,并标出电子转移的方向和数目: ;
(5)Ti倍称为继铁铝之后“21世纪”金属,应用前景很广.钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体.在25℃、101KPa下,已知煤消耗7克CO,吸收aKJ热量,该反应的热化学方程式为 .
考点: 原子核外电子排布;原子结构示意图;氧化还原反应的电子转移数目计算;热化学方程式.
分析: (1)根据Si为14号元素,核外电子排布为2,8,4,根据电子层数=周期数,最外层电子数=主族数判断位置,铁原子为26号元素,则Fe2+的离子核外有24个电子,根据构造原理每一层上的电子数为2、8、14据此书写,Cl为17号元素,其基态原子外围电子层排布式即为最外层电子排布式;
(2)同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族元素大于第IIIA族元素,第VA族元素大于第VIA族元素;
键能与键长成反比,键长与半径成正比,据此分析;
分子晶体的熔沸点与是否存在氢键有关,存在氢键的熔沸点一般较高;
(3)根据漂白粉放空气中会转化成碳酸钙结合强酸制弱酸分析;
(4)根据题干信息,氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水;
(5)由钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体,则方程式为FeTiO3+CO=TiO2+Fe+CO2,又已知消耗7克CO,吸收aKJ热量,所以消耗28克即1molCO,吸收4aKJ热量,据此书写热化学方程式.
解答: 解:(1)Si为14号元素,核外电子排布为2、8、4,则电子层数=周期数,最外层电子数=主族数,所以硅在第三周期第ⅣA族;铁原子为26号元素,则Fe2+的离子核外有24个电子,根据构造原理每一层上的电子数为2、8、14,则Fe2+的离子结构示意图为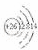 ;Cl为17号元素,其基态原子外围电子层排布式即为最外层电子排布式3s23p5;故答案为:三;ⅣA;
;Cl为17号元素,其基态原子外围电子层排布式即为最外层电子排布式3s23p5;故答案为:三;ⅣA;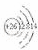 ;3s23p5;
;3s23p5;
(2)同一周期中,元素的第一电离能是指失去第一个电子的难易程度,氧属于第二周期,而钠属于第三周期,且钠最外层只有1个电子很容易失去,氧最外层有6个电子很难失去,所以第一电离能:O>Na;
键能与键长成反比,键长与半径成正比,又Cl的半径比硅小,所以H﹣Cl的键长比H﹣Si短,则H﹣Cl的键能比H﹣Si大;
分子晶体的熔沸点与是否存在氢键有关,存在氢键的熔沸点一般较高,又水分子间存在氢键,所以熔沸点:CO2<H2O;故答案为:>;>;<;
(3)漂白粉中的次氯酸钙与空气中的二氧化碳及水发生反应,生成碳酸钙和次氯酸反应的化学方程式为:Ca(ClO)2+CO2+H2O═CaCO3+2HClO,根据强酸制弱酸,则此方程式可以说明碳酸酸性比次氯酸强;
故答案为:Ca(ClO)2+CO2+H2O═CaCO3+2HClO;
(4)根据题干信息,氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水,该反应为2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O,双线桥标出电子转移的方向和数目为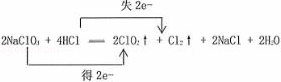 ,故答案为:
,故答案为: ;
;
(5)由钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体,则方程式为FeTiO3+CO=TiO2+Fe+CO2,又已知消耗7克CO,吸收aKJ热量,所以消耗28克即1molCO,吸收4aKJ热量,所以该反应的热化学方程式为FeTiO3(s)+CO(g)=TiO2(s)+Fe(s)+CO2(g))△H=+4aKJ•mol﹣1,
故答案为:FeTiO3(s)+CO(g)=TiO2(s)+Fe(s)+CO2(g))△H=+4aKJ•mol﹣1.
点评: 本题考查知识点较多,涉及原子结构和元素周期律、反应热的计算、化学方程式书写和氧化还原反转移电子数的计算和表示方法,为2015届高考常见题型,侧重于学生计算能力、分析比较能力的培养.


科目:高中化学 来源: 题型:
不能用有关胶体的观点解释的现象是( )
|
| A. | 在河流人海口处易形成三角洲 |
|
| B. | 在NaHCO3溶液中滴入CaCl2溶液,看不到沉淀 |
|
| C. | 少许FeCl3饱和溶液逐滴滴入沸水中,看不到红褐色沉淀 |
|
| D. | 同一支钢笔,同时使用不同牌号的墨水易发生堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分子式为C12H12的物质A的结构简式为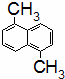 ,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有()
,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有()
A. 9种 B. 10种 C. 11种 D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C. 某气态烃CxHy与足量O2恰好完全反应(温度>100℃),如果反应前后气体体积不变,则y=4
D. 相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现下列实验目的,下表所提供的实验仪器和试剂都会用到且都正确的是()
选项 实验目的 主要仪器 试剂
A 测定中和热 量筒、温度计、酒精灯 盐酸、NaOH溶液
B 制备氢氧化铁胶体 烧杯、胶头滴管 饱和FeCl3溶液
C 配制10%CuSO4溶液100g 100ml 容量瓶、玻璃棒 胆矾
D 实验室制取、收集干燥的氮气 大试管、酒精灯 氯化铵、消石灰、无水CaCl2
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH
D. 用惰性电极电解浓CuSO4溶液一小段时间后,加入Cu2O固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同条件下,分别测得反应2SO2+O2⇌2SO3的速率如下,其中最快的是()
A. v(SO3)=4 mol•L﹣1•min﹣1 B. v(O2)=2 mol•L﹣1•min﹣1
C. v(SO2)=5 mol•L﹣1•min﹣1 D. v(SO2)=0.1 mol•L﹣1•S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法正确的是()
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100mL2mol•L﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
VL Fe2(SO4)3溶液中含有Fe3+mg,则溶液中SO42﹣的物质的量浓度为()
A. 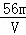 mol/L B.
mol/L B. 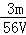 mol/L C.
mol/L C. 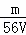 mol/L D.
mol/L D. 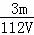 mol/L
mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com