
分析 原子序数小于20的X、Y、Z、W四种元素,Y原子基态时最外层电子数是其内层电子总数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;X是形成化合物种类最多的元素之一,原子序数小于碳,故X为H元素;Z原子基态时2p原子轨道上有3个未成对电子,原子核外电子排布为1s22s22p6,则Z为N元素;W形成的常见单质既能与强酸反应,又能与强碱反应,则W为Al.
(1)C2H4分子碳原子形成1个C=C双键、2个C-H单键,碳原子杂化轨道数目为3;
(2)原子数目相等、价电子总数也相等的微粒互为等电子体;
(3)氨气能与水发生反应,NH3分子与水分子之间形成氢键,增大物质的溶解性,氨气分子与水分子均为极性分子,相似相溶;
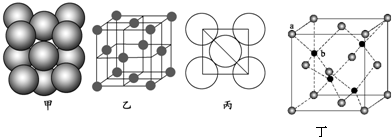
(4)铝与强碱溶液反应生成偏铝酸盐与氢气;Al晶体属于面心立方密堆积;若已知Al的原子半径为d,则晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,根据均摊法计算晶胞中Al原子数目,用阿伏伽德罗常数表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算密度;
(5)立方体的顶点和面心位置为Zn2+,晶胞中Zn2+数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,晶胞中S2-数目为4,则二者配位数相等;
a位置Zn2+与b位置S2-之间的连线处于晶胞体对角线上,且二者之间的距离为晶胞体对角线长度的$\frac{1}{4}$,而晶胞体对角线长度为晶胞边长的$\sqrt{3}$倍.
解答 解:原子序数小于20的X、Y、Z、W四种元素,Y原子基态时最外层电子数是其内层电子总数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;X是形成化合物种类最多的元素之一,原子序数小于碳,故X为H元素;Z原子基态时2p原子轨道上有3个未成对电子,原子核外电子排布为1s22s22p6,则Z为N元素;W形成的常见单质既能与强酸反应,又能与强碱反应,则W为Al.
(1)C2H4分子碳原子形成1个C=C双键、2个C-H单键,碳原子杂化轨道数目为3,碳原子采取sp2杂化,1mol C2H4含有σ键的数目为5×6.02×1023个,
故答案为:sp2;5×6.02×1023;
(2)元素碳的一种氧化物与元素氮的一种氧化物互为等电子体,为CO2与N2O,元素Z的这种氧化物的分子式是N2O,
故答案为:N2O;
(3)氨气能与水发生反应,NH3分子与水分子之间形成氢键,增大物质的溶解性,而甲烷不能,氨气分子与水分子均为极性分子,相似相溶,而甲烷为非极性分子,故氨气的溶解度大于甲烷的,
故答案为:氨气可以和水反应,且NH3分子与水分子间可以形成氢键,氨气与水分子都是极性分子,相似相溶;
(4)铝与强碱溶液反应生成偏铝酸盐与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al晶体属于面心立方密堆积,顶点Al原子与面心Al原子相切,Al原子配位数为12,若已知Al的原子半径为d,
则晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,晶胞中Al原子数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,则晶胞质量为4×$\frac{M}{{N}_{A}}$,则晶体密度为
4×$\frac{M}{{N}_{A}}$÷d3=$\frac{4M}{{N}_{A}•{d}^{3}}$,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;12;$\frac{4M}{{N}_{A}•{d}^{3}}$;
(5)立方体的顶点和面心位置为Zn2+,晶胞中Zn2+数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,晶胞中S2-数目为4,则二者配位数相等,S2-的配位数为4,则Zn2+的配位数也是4,
a位置Zn2+与b位置S2-之间的连线处于晶胞体对角线上,且二者之间的距离为晶胞体对角线长度的$\frac{1}{4}$,而晶胞体对角线长度为晶胞边长的$\sqrt{3}$倍,即a位置Zn2+与b位置S2-之间的距离为$\frac{\sqrt{3}}{4}$a pm,
故答案为:4;$\frac{\sqrt{3}}{4}$a.
点评 本题以元素推断为载体,综合考查物质结构与性质,涉及核外电子排布规律、杂化方式判断、化学键、等电子体、晶胞结构与计算等,(5)中距离计算为易错点、难度,需要学生具备一定的空间想象与数学计算能力,注意掌握利用均摊法进行晶胞有关计算.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:推断题
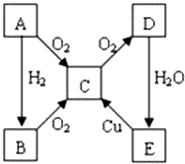 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.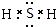 ;
; CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
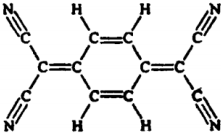
| A. | 分子中所有的氮原子在同一平面内 | B. | 属于芳香烃 | ||
| C. | 分子式为C12H4N4 | D. | 该物质易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液 | |
| B. | 进行中和滴定操作中,眼睛要始终注视滴定管内溶液液面的变化 | |
| C. | 测定中和热时,两烧杯间填满碎纸的作用是固定小烧杯 | |
| D. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两反应的中和热不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(新制CaO) | ||
| C. | 乙醛中的乙酸(NaOH) | D. | 乙酸乙酯中的乙酸(饱和NaHCO3溶液) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com