
 ;
;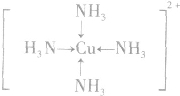 ;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
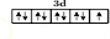
;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;分析 (1)Cu元素原子核外电子数为29,外围电子排布式为3d104s1;Cu原子失去4s、3d能级的1个电子形成Cu2+;
(2)[Cu(NH3)4]2+中铜离子含有空轨道、氨分子中N原子含有孤电子对,二者形成配位键,配位键由含有孤电子对的原子指向含有空轨道的原子,据此画出其结构简式;四氨合铜离子形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(3)根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型;原子总数、价电子总数相同的离子也是等电子体;
(4)根据(SCN)2分子结构式为N≡C-S-S-C≡N计算;分子间有氢键的能使物质熔沸点升高.
解答 解:(1)Cu元素原子核外电子数为29,外围电子排布式为3d104s1,则铜位于第四周期第IB族元素;Cu原子失去4s、3d能级的1个电子形成Cu2+,其价电子排布图为: ,故答案为:第四周期第IB族;
,故答案为:第四周期第IB族; ;
;
(2)[Cu(NH3)4]2+中铜离子含有空轨道、氨分子中N原子含有孤电子对,二者形成配位键,配位键由含有孤电子对的原子指向含有空轨道的原子,据此画出其结构简式: ;四氨合铜离子形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
;四氨合铜离子形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为: ;四氨合铜离子;平面正方形;
;四氨合铜离子;平面正方形;
(3)SO42-中心原子含有4个σ键,孤电子对数=$\frac{1}{2}$(6+2-4×2)=0,所以其空间构型为正四面体结构;SO42-属于等电子体的离子团有PO43-、ClO4-,
故答案为:正四面体;PO43-、ClO4-;
(4)(SCN)2分子结构式为N≡C-S-S-C≡N,1个N≡C键中有1个σ键,其余两个为π键,1mol(SCN)2分子中含有π键的数目4NA,异硫氰酸(H-N=C=S)分子中N原子上连接有H原子,分子间能形成氢键,故沸点高,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能.
点评 本题考查了原子结构、配合物成键情况等知识,题目难度中等,明确分析配合物成键情况的方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成0.1molO2转移的电子数为0.2NA | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | 100ml0.2mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA | |
| D. | 密闭容器中2molNO与1molO2充分反映,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| B. | 将25 g CuSO4•5H2O溶于100 mL蒸馏水配制100 mL 1.0 mol•L-1 CuSO4溶液 | |
| C. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| D. | 配制100 mL 0.100 0 mol•L-1 K2Cr2O7溶液所选择的装置或仪器(夹持装置已略去)是 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
| A. | 甲的最高价氧化物对应水化物的碱性比丙的强 | |
| B. | 甲单质可用电解其盐溶液的方法冶炼而得 | |
| C. | 常温下,丁的两种氢化物均为液体 | |
| D. | 乙的简单离子是四种元素各自形成的简单离子中半径最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化成溶解度更小的沉淀 | |
| C. | 25℃时,在饱和AgCl、AgI、Ag2S溶液中所含c(Ag+)不同 | |
| D. | AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ④癸烷⑤CH3COOH ⑥
④癸烷⑤CH3COOH ⑥ ⑦
⑦ ⑧
⑧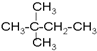 ⑨丙烷
⑨丙烷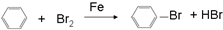 ;
; ;
;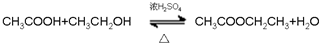 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com